题目内容
13.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+═2Fe3++2H2O;2Fe3++H2O2═2Fe2++O2↑+2H+.下列说法中,不正确的是( )| A. | 在H2O2分解过程中,Fe2+是反应的催化剂 | |
| B. | 在H2O2生产过程中,要严格避免混入 Fe2+ | |
| C. | H2O2的氧化性比Fe3+强,还原性比Fe2+强 | |
| D. | 在H2O2分解过程中,溶液的pH逐渐下降 |
分析 根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,结合具体的化学反应来解答.
解答 解:A.由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2分解的总方程式为:2H2O2═2H2O+O2↑,所以Fe2+是反应的催化剂,故A正确;
B.因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故B正确;
C.由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,故C正确;
D.将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,双氧水溶液本身是弱酸性,而分解生成的水是中性,溶液pH值升高,故D错误.
故选:D.
点评 本题考查氧化还原反应,明确反应中氧化性的比较规律及两个化学反应的关系及催化剂在反应在的作用即可解答,难度不大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
3.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取.
①分离出甲醇的操作是的蒸馏.
②萃取用到的分液漏斗使用前需检验漏并洗净,分液时有机层在分液漏斗的上填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是①除去HCl;用饱和食盐水洗涤的目的是②除去少量NaHCO3且减少产物损失.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)反应可能出现的副产物的结构简式为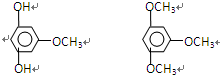 .
.

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 | / | 33~36 | / | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是的蒸馏.
②萃取用到的分液漏斗使用前需检验漏并洗净,分液时有机层在分液漏斗的上填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是①除去HCl;用饱和食盐水洗涤的目的是②除去少量NaHCO3且减少产物损失.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是dcab(填字母).
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)反应可能出现的副产物的结构简式为
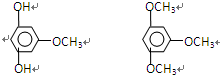 .
.
4.对于容积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g);△H<0,在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述不正确的是( )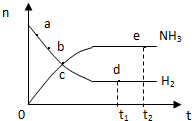

| A. | 点a处的正反应速率比点b处的大 | |
| B. | 点c处的正反应速率与逆反应速率相等 | |
| C. | 点d(t1时刻)的n(N2)比点e(t2时刻)处的n(N2)大 | |
| D. | 其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变小 |
1.下列表达中不正确的是( )
| A. | 1molH2 | B. | 2 molNa2CO3 | C. | 0.5mol氧 | D. | 2 molOH- |
8.下列各组离子在无色酸性溶液中能大量共存的是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
5.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
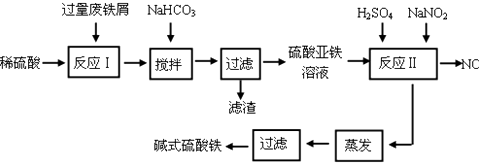
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)如何加快废铁屑的溶解,写出两种办法搅拌、加热.
(2)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(3)反应Ⅱ中加入NaNO2的目的是将亚铁离子氧化为铁离子.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为C.
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为g/L.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)如何加快废铁屑的溶解,写出两种办法搅拌、加热.
(2)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(3)反应Ⅱ中加入NaNO2的目的是将亚铁离子氧化为铁离子.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为C.
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为g/L.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).
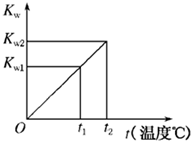 水的离子积常数Kw与温度t(℃)的关系如图所示:
水的离子积常数Kw与温度t(℃)的关系如图所示: