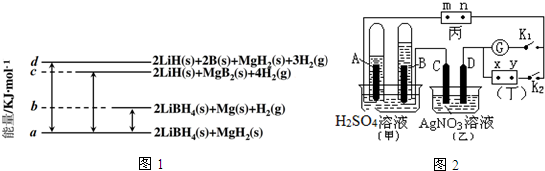题目内容
17.中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去).请回答下列有关问题:(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中.则A与C反应的离子方程式为2Fe3++Fe=3Fe2+.
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性.写出上述反应的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CaCl+2NH3↑+2H2O.
分析 (1)铁与过量的稀硝酸反应生成硝酸铁、一氧化氮和水,A可溶于C溶液中,则C为硝酸铁,D为NO;
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,为二氧化碳和二氧化硫,应是碳和浓硫酸能反应生成二氧化碳、二氧化硫和水;
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性,则C为氨气,应是氯化铵与氢氧化钙反应生成氨气、氯化钙与水.
解答 解:(1)(1)铁与过量的稀硝酸反应生成硝酸铁、一氧化氮和水,A可溶于C溶液中,则C为硝酸铁,D为NO,铁和铁离子能发生氧化还原反应生成亚铁离子,离子反应方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,而为二氧化碳和二氧化硫,碳和浓硫酸能发生氧化还原反应生成二氧化碳、二氧化硫和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性,则C为氨气,应是氯化铵与氢氧化钙反应生成氨气、氯化钙与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CaCl+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CaCl+2NH3↑+2H2O.
点评 本题考查无机物推断,涉及Fe、硝酸、浓硫酸的性质及实验室氨气的制备,比较基础,注意基础知识的积累掌握.

练习册系列答案
相关题目
8.已知C-C单键可以绕键轴旋转,某烃的结构简式如图,下列说法中正确的是( )
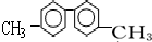
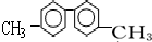
| A. | 该烃分子中有六种不同环境的氢原子 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使高锰酸钾和溴水褪色 |
5. 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H10O3 | |
| B. | 1mol该有机物最多能与2mol H2发生加成反应 | |
| C. | 该有机物的一种芳香族同分异构体能发生银镜反应 | |
| D. | 该有机物能发生取代、加成、氧化和还原反应 |
2.在2L容积不变的容器中,发生N2+3H2?2NH3的反应.现通入4mol H2和4mol N2,10s内用H2表示的反应速率为0.12mol/(L•s),则10s后容器中N2的物质的量是( )
| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
6.下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式1s222s2p63s23p63d5;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式Cl2+H2O=HCl+HClO;
(3)请比较b、e、j三种元素的电负性由大到小的顺序Cl>Al>Mg(写元素符号);此三种元素的第一电离能由大到小的顺序Cl>Mg>Al(写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式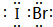 ,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
| a | |||||||||||||||||
| f | h | i | |||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | k | ||||||||||||||
| l | |||||||||||||||||
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式Cl2+H2O=HCl+HClO;
(3)请比较b、e、j三种元素的电负性由大到小的顺序Cl>Al>Mg(写元素符号);此三种元素的第一电离能由大到小的顺序Cl>Mg>Al(写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式
 ,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
7.钠、镁、铝三种金属单质的混合物跟足量的稀硫酸溶液充分反应后,得到标准状况下的氢气2.24L,则这三种金属的总物质的量可能是( )
| A. | 0.050 mol | B. | 0.060 mol | C. | 0.100 mol | D. | 0.200 mol |
 ).则1mol的该有机物跟足量的金属钠反应可以产生1.5molH2,1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟2molNaOH反应.
).则1mol的该有机物跟足量的金属钠反应可以产生1.5molH2,1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟2molNaOH反应.