题目内容
6.下列叙述都涉及化学相关知识,其中正确的是( )| A. | 将置于海水中的钢铁设备作为阴极,接上直流电源和辅助阳极,使其受到保护的方法叫牺牲阳极的阴极保护法 | |
| B. | 200mlmol/LFe2(SO4)3溶液,Fe3+和SO42-,离子总数为NA | |
| C. | 10g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
分析 A、将被保护的金属做电解池的阴极,可以被保护;
B、Fe3+是弱碱阳离子,在溶液中会水解;
C、乙醇溶液中,乙醇和水均含氢原子;
D、Mg2+在水溶液中不放电.
解答 解:A、将被保护的金属做电解池的阴极,可以被保护,故是外加电源的阴极保护法,故A错误;
B、Fe3+是弱碱阳离子,在溶液中会水解,故导致溶液中Fe3+和SO42-离子总数小于NA,故B错误;
C、10g46%的乙醇的物质的量为0.1mol,所含氢原子数目为0.6NA;10g46%的乙醇中含水5.4g,物质的量为0.3mol,所含氢原子数为0.6NA,共含有氢原子数 为1.2NA,故C正确;
D、Mg2+在水溶液中不放电,故应电解氯化镁固体来制取金属镁,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是除杂方法分析,溶液中微粒的计算应用,注意盐类水解和电解原理的判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
16.下列现象中,不能用有关胶体的知识解释的是( )
| A. | 豆浆中加入石膏做豆腐 | |
| B. | 在河流入海口处易形成三角洲 | |
| C. | 在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| D. | 清晨的阳光穿过茂密的林木枝叶产生美丽的光线 |
14. 乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
 乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )| A. | 与金属钠反应时,键①断裂 | |
| B. | 在加热和Cu催化下与O2反应时,键①、③断裂 | |
| C. | 与浓硫酸共热发生消去反应时,键②③断裂 | |
| D. | 与乙酸、浓硫酸共热发生酯化反应时,键①断裂 |
1.氰酸铵(NH4OCN)与尿酸[CO(NH2)2]( )
| A. | 都是共价化合物 | B. | 都是离子化合物 | C. | 互为同素异形体 | D. | 互为同分异构体 |
11.你认为下列说法正确的是( )
| A. | 含有N、O、F的分子和含有氢原子的分子间一定存在氢键 | |
| B. | 对于组成和结构相似的分子,其沸点随着相对分子质量的增大一定增大 | |
| C. | 甲醇极易溶于水而CH4难溶于水的原因只是甲醇是极性分子,CH4是非极性分子 | |
| D. | 过氧化氢气化时肯定只破坏分子间作用力和氢键 |
18.下列有关金属的工业制法中,正确的是( )
| A. | 制铁:以铁矿石为原料,CO还原得铁 | |
| B. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
5.蛋白质发生的下列过程中,可逆的是( )
| A. | 变性 | B. | 加入酒精 | C. | 加入氯化铵 | D. | 加入浓硫酸 |
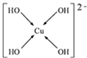 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.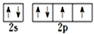 .
.