题目内容
20.下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是( )| A. | 升高温度 | B. | 用Zn粉代替Zn粒 | ||
| C. | 改用0.1mol/LH2SO4与Zn反应 | D. | 滴加少量的CuSO4溶液 |
分析 增大反应速率可增大浓度、升高温度或增大固体的表面积,注意不能用浓硫酸,也可形成原电池反应,以此解答.
解答 解:A.升高温度,活化分子百分数增加,反应速率增大,故A不选;
B.用Zn粉代替Zn粒,固体表面积增大,反应速率增大,故B不选;
C.改用0.1mol/LH2SO4与Zn反应,硫酸浓度减小,反应速率减小,故C选;
D.滴加少量的CuSO4溶液,锌置换出铜,形成原电池反应,可加快反应速率,故D不选.
故选C.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意原电池反应的特点,为易错点.

练习册系列答案
相关题目
10.下列物质中,能导电且为电解质的是( )
| A. | 铜 | B. | 固体Na2CO3 | C. | 熔融态KOH | D. | 稀H2SO4 |
11.你认为下列说法正确的是( )
| A. | 含有N、O、F的分子和含有氢原子的分子间一定存在氢键 | |
| B. | 对于组成和结构相似的分子,其沸点随着相对分子质量的增大一定增大 | |
| C. | 甲醇极易溶于水而CH4难溶于水的原因只是甲醇是极性分子,CH4是非极性分子 | |
| D. | 过氧化氢气化时肯定只破坏分子间作用力和氢键 |
5.下列用来解释实验事实的相关平衡方程式不正确的是( )
| 实验事实 | 相关平衡方程式 | |
| A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O?HClO+HCl |
| B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH-?Fe(OH)3 |
| C | 溶有CO2的正常雨水pH=5.6 | H2O+CO2?H2CO3?H++HCO3 |
| D | CaCO3固体溶于盐酸 | CaCO3(s)?Ca2+(aq)+CO32(aq) |
| A. | A | B. | B | C. | C | D. | D |
12.卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子.若以它为原料按如图所示工艺流程进行生产,可制得轻质氧化镁.

已知1:生成氢氧化物沉淀的pH
已知2:几种难容电解质的溶解度(20℃)
(已知:Fe+氢氧化物呈絮状,不易从溶液中除去)
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO).
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、强氧化性.
②用化学用语表示NaClO溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
③步骤Ⅱ中漂液的主要作用是将Fe2+氧化为Fe3+.
④若用H2O2代替漂液,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去.
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为Mg2++CO32-=MgCO3↓.
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解,Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.

已知1:生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 溶解度/g |
| Fe(OH)2 | 5.2×10-5 |
| Fe(OH)3 | 3×10-9 |
| MgCO3 | 3.9×10-2 |
| Mg(OH)2 | 9×10-4 |
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO).
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、强氧化性.
②用化学用语表示NaClO溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
③步骤Ⅱ中漂液的主要作用是将Fe2+氧化为Fe3+.
④若用H2O2代替漂液,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去.
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为Mg2++CO32-=MgCO3↓.
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解,Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.
19.下列事实中,与电化学腐蚀无关的是( )
| A. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| B. | 在空气中,金属银的表面生成一层黑色物质 | |
| C. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| D. | 镀银的铁质品,镀层部分受损后,露出的铁表面更易被腐蚀 |
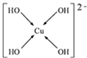 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.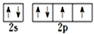 .
.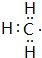 ,结构式为
,结构式为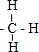 ;
;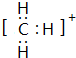 ,结构式为
,结构式为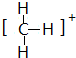 ;
;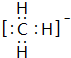 ,结构式为
,结构式为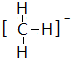 ;
;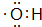 ,结构式为-O-H;
,结构式为-O-H;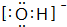 ,结构式为[O-H]-.
,结构式为[O-H]-.