题目内容
16.能将已烯、已烷、乙醇、乙酸、乙醛、苯酚、硝酸银溶液7种物质鉴别开来的试剂组是( )| A. | 氯化铁溶液、烧碱溶液、金属钠 | B. | 烧碱溶液、紫色石蕊试液 | ||
| C. | 新制Cu(OH)2悬浊液、紫色石蕊试液 | D. | 新制Cu(OH)2悬浊液、溴水 |
分析 有机物中,己烯含有碳碳双键,可与溴水反应,苯酚与溴水发生取代反应生成沉淀,硝酸银与溴水反应生成浅黄色沉淀,乙醛与氢氧化铜发生氧化还原反应,乙酸具有酸性,以此解答该题.
解答 解:A.氯化铁只能检验苯酚、硝酸银,烧碱、金属钠不能鉴别乙醇、乙酸,故A错误;
B.烧碱、石蕊不能检验己烯、己烷,故B错误;
C.氢氧化铜可检验乙酸、乙醛,但紫色石蕊只能检验乙酸,故C错误;
D.加入氢氧化铜,可检验乙酸、乙醛,加入溴水,己烯发生加成反应,己烷分层,乙醇无现象,苯酚生成白色沉淀,硝酸银生成浅黄色沉淀,可鉴别,故D正确.
故选D.
点评 本题考查物质的鉴别,题目难度较大,把握物质的性质与反应现象为解答本题的关键,涉及的反应较多,注意氧化还原反应及相互促进水解反应为解答的难点,要注意总结和积累.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
6.Cu(NO3)2是制备Ca-Zn-Al系列催化剂的重要原料,制取Cu(NO3)2现有三种方案
①Cu与稀硝酸反应制取:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3═Cu(NO3)2+2NO↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O
下列说法正确的是( )
①Cu与稀硝酸反应制取:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3═Cu(NO3)2+2NO↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O
下列说法正确的是( )
| A. | 制取相同量的Cu(NO3)2 需硝酸的量③最多 | |
| B. | 制取相同量的Cu(NO3)2,①产生的有毒气体的物质的量比②多 | |
| C. | 从环保角度考虑,应选用方案③ | |
| D. | 三种方案的反应都可以在铁制容器中进行 |
11.你认为下列说法正确的是( )
| A. | 含有N、O、F的分子和含有氢原子的分子间一定存在氢键 | |
| B. | 对于组成和结构相似的分子,其沸点随着相对分子质量的增大一定增大 | |
| C. | 甲醇极易溶于水而CH4难溶于水的原因只是甲醇是极性分子,CH4是非极性分子 | |
| D. | 过氧化氢气化时肯定只破坏分子间作用力和氢键 |
5.下列用来解释实验事实的相关平衡方程式不正确的是( )
| 实验事实 | 相关平衡方程式 | |
| A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O?HClO+HCl |
| B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH-?Fe(OH)3 |
| C | 溶有CO2的正常雨水pH=5.6 | H2O+CO2?H2CO3?H++HCO3 |
| D | CaCO3固体溶于盐酸 | CaCO3(s)?Ca2+(aq)+CO32(aq) |
| A. | A | B. | B | C. | C | D. | D |
15.下列化学方程式不正确的是( )
| A. | 铁与稀硫酸反应:2Fe+3H2SO4═3 H2↑+Fe2(SO4)3 | |
| B. | 铝与氧化铁反应 2Fe2O3+2Al$\frac{\underline{\;点燃\;}}{\;}$AL2O3+2Fe | |
| C. | 小苏打溶液与盐酸反应 NaHCO3+HCl═NaCl+CO2↑+H2O | |
| D. | 泡沫灭火器工作原理:6NaHCO3+Al2(SO4)3═3Na2SO4+2Al(OH)3↓+6 CO2↑ |
 .
.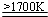 2AlN+3H2.
2AlN+3H2.
 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内最多
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内最多