题目内容
4.将一定质量的甲烷完全燃烧,将生成的气体依次通过装有足量无水CaCl2和NaOH的玻璃管中,结果盛NaOH的玻璃管的质量增加了2.2g.则原来通入的甲烷在标准状况下的体积为( )| A. | 0.56L | B. | 1.12L | C. | 1.68L | D. | 2.24L |
分析 甲烷燃烧生成二氧化碳与水,无水CaCl2吸收生成的水,NaOH吸收生成的二氧化碳,根据n=$\frac{m}{M}$计算二氧化碳的物质的量,根据碳原子守恒计算甲烷物质的量,再根据V=nVm计算甲烷体积.
解答 解:甲烷燃烧生成二氧化碳与水,无水CaCl2吸收生成的水,NaOH吸收生成的二氧化碳,即生成二氧化碳的质量为2.2g,二氧化碳的物质的量=$\frac{2.2g}{44g/mol}$=0.05mol,根据碳原子守恒,甲烷物质的量=0.05mol,故标况下,甲烷体积=0.05mol×22.4L/mol=1.12L,故选B.
点评 本题考查化学方程式有关计算,比较基础,判断二氧化碳质量是关键,注意利用原子守恒计算,简化计算步骤.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
14.除去括号内杂质所用试剂和方法,正确的是( )
| 选项 | 物质 | 所用试剂 | 方法 |
| A. | 乙醇(乙酸) | 碳酸钠溶液 | 分液 |
| B. | 溴苯(溴) | 氢氧化钠溶液 | 蒸馏 |
| C. | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| D. | 乙醇(水) | 生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
15.氰酸铵(NH4CNO)与尿素[CO(NH2)2]( )
| A. | 互为同系物 | B. | 互为同分异构体 | C. | 都是共价化合物 | D. | 都是有机化合物 |
9.0.1mol•L-1下列溶液与0.2mol•L-1氢氧化钡溶液等体积混合,产生沉淀质量最大的是( )
| A. | KAl(SO4)2 | B. | NH4Al(SO4)2 | C. | (NH4)2Fe(SO4)2 | D. | NH4Fe(SO4)2 |
20.下列物质的沸点逐渐升高的是( )
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
1.下列关于甲烷的说法不正确的是( )
| A. | 甲烷的分子式是CH4,是H元素质量分数含量最高的烃 | |
| B. | 甲烷中最多三个原子共面 | |
| C. | CCl4可由CH4制得,CCl4可萃取碘水中的碘 | |
| D. | 1 mol甲烷和氯气光照充分反应,最多消耗2mol氯气 |
 )加氢产物1,2-二甲基环乙烷(
)加氢产物1,2-二甲基环乙烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )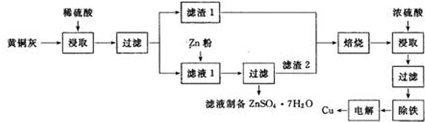 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.