题目内容
1.下列关于甲烷的说法不正确的是( )| A. | 甲烷的分子式是CH4,是H元素质量分数含量最高的烃 | |
| B. | 甲烷中最多三个原子共面 | |
| C. | CCl4可由CH4制得,CCl4可萃取碘水中的碘 | |
| D. | 1 mol甲烷和氯气光照充分反应,最多消耗2mol氯气 |
分析 A、根据氢元素和碳元素的原子个数之比数值越大,H元素质量分数含量越高来回答;
B、根据甲烷是正四面体结构来判断;
C、四氯化碳是甲烷的完全取代产物,是一种有机溶剂;
D、甲烷中的四个氢原子均可以倍Cl原子取代,根据取代规律来回答.
解答 解:A、甲烷的分子式是CH4,甲烷中氢元素和碳元素的原子个数之比数值越大,H元素质量分数含量最高,故A正确;
B、甲烷是正四面体结构,最多三个原子共面,故B正确;
C、四氯化碳是甲烷的完全取代产物,可由CH4制得,是一种有机溶剂,和水互不相溶,碘在其中的溶解度大于在水中的溶解度,可萃取碘水中的碘,故C正确;
D、甲烷中的四个氢原子均可以倍Cl原子取代,1 mol甲烷中有4mol氢原子,和氯气光照充分反应,最多消耗4mol氯气,故D错误.
故选D.
点评 本题考查学生甲烷的结构、和氯气的取代反应以及四氯化碳的有关知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
4.将一定质量的甲烷完全燃烧,将生成的气体依次通过装有足量无水CaCl2和NaOH的玻璃管中,结果盛NaOH的玻璃管的质量增加了2.2g.则原来通入的甲烷在标准状况下的体积为( )
| A. | 0.56L | B. | 1.12L | C. | 1.68L | D. | 2.24L |
9.Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂.工业上制得的Na2S2O3•5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质.为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.(Na2S2O3+H2SO4γNa2SO4+SO2↑+S↓+H2O)
测得有关实验数据如下(标准状况):
(摩尔质量:Na2S2O3•5H2O 248g/mol; Na2SO3126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
16.常见的离子晶体类型有五种,右图是其中的一种空间构型.则该晶体的化学式可能为( )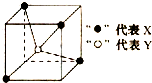

| A. | YX4 | B. | XY2 | C. | YX | D. | YX2 |
6.下列说法正确的是( )
| A. | 二氧化锰是催化剂,能加快反应速率 | |
| B. | 温度越高,催化剂的催化效果越好 | |
| C. | 食品包装袋中的抗氧化剂就是“负催化剂”,能使氧化还原反应的速率减慢 | |
| D. | 升高温度,吸热反应和放热反应的反应速率都加快 |
13.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA | |
| B. | 1mol/LFeCl3 溶液中所含Fe3+的数目小于NA | |
| C. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| D. | 23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
11.下列分子中所有碳原子肯定在同一平面上的是( )
| A. | 丙烷 | B. | 异丁烷 | C. | 2-丁烯 | D. | 1-丁烯 |