题目内容
19.对于反应A(g)+B(g)?3C(g)(正反应、放热反应),下述为平衡状态的标志的①③⑤.①单位时间内A、B生成C的分子数与分解C的分子数相等
②外界条件不变时,A、B、C浓度随时间变化
③体系温度不再变化
④体系压强不再变化
⑤体系分子总数不再变化
⑥体系的密度不再变化.
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:①单位时间内A、B生成C的分子数与分解C的分子数相等,说明正逆反应速率相等,反应达到平衡状态,故正确;
②外界条件不变时,A、B、C浓度随时间变化,说明正逆反应速率不相等,反应没有达到平衡状态,故错误;
③体系温度不再变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
④体系压强不再变化,若为恒压容器,体系压强始终不变,所以压强不变不能说明反应达到平衡状态,故错误;
⑤体系分子总数不再变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
⑥体系的密度不再变化,若为恒容容器,密度始终不变,所以密度不变不能说明反应达到平衡状态,故错误;
故答案为:①③⑤.
点评 本题考查化学平衡状态的判断,题目难度不大,注意恒容容器和恒压容器的不同,注意平衡时的浓度关系、物质的量关系不能作为判断是否平衡的依据.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
9.下列各物质中,互为同系物的是( )
| A. | 氯仿和氯乙烷 | B. | HCOOCH3和CH3COOH | ||
| C. | 油酸和硬脂酸 | D. | C3H8和C17H36 |
7.下列说法中正确的是( )
| A. | 在一定体积和浓度的醋酸和氢氧化钠的混合液中一定存在:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) | |
| B. | 常温下pH=10的NaOH和NH3•H2O,加水稀释至pH=9,NaOH加水多 | |
| C. | 难溶电解质CaF2饱和溶液中,c(Ca2+)=amol/L,c(F-)=bmol/L,则Ksp=4ab | |
| D. | 0.1mol/L的碳酸钠溶液中,阴离子浓度大小顺序为:c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) |
14.下列说法不正确的是( )
| A. | 溶液中滴加盐酸酸化的BaCl2溶液出现被色沉淀,则溶液中不一定存在SO${\;}_{4}^{2-}$ | |
| B. | 形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体 | |
| C. | 氯气泄漏自救方法是用湿毛巾或蘸有纯碱水的毛巾捂住口鼻并向地势低的地方撤离 | |
| D. | 大气中的N2可转化为NO,NO可转化为NO2、硝酸等,含硫物质在自然界中可转化为SO2等含硫化合物 |
4.将一定质量的甲烷完全燃烧,将生成的气体依次通过装有足量无水CaCl2和NaOH的玻璃管中,结果盛NaOH的玻璃管的质量增加了2.2g.则原来通入的甲烷在标准状况下的体积为( )
| A. | 0.56L | B. | 1.12L | C. | 1.68L | D. | 2.24L |
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | NH4Cl溶于重水(D2O)生成NH3D2O和HD2O+ | |
| D. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
15.下列关于${\;}_{2}^{3}He$的说法中正确的是( )
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
16.常见的离子晶体类型有五种,右图是其中的一种空间构型.则该晶体的化学式可能为( )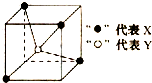

| A. | YX4 | B. | XY2 | C. | YX | D. | YX2 |