题目内容
20.下列物质的沸点逐渐升高的是( )| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
分析 A.氨气分子之间存在氢键,沸点高于PH3;
B.原子晶体沸点高于分子晶体,金刚石、晶体硅属于原子晶体,原子半径越小,键能越大,熔沸点越高,水与二氧化碳均形成分子晶体,常温下水为液态,而二氧化碳为气体;
C.晶格能越大,离子晶体熔沸点越高,离子电荷越大、半径越小,晶格能越大;
D.金属键越强,金属晶体的熔沸点越高,离子电荷越大、半径越小,金属键越强.
解答 解:A.氨气分子之间存在氢键,沸点高于PH3,故A错误
B.金刚石、晶体硅属于原子晶体,原子半径C<Si,故键能C-C键>C-Si键,故沸点Si<SiC,水与二氧化碳均形成分子晶体,常温下水为液态,而二氧化碳为气体,水的沸点较高,原子晶体的沸点高于分子晶体,故B错误;
C.均为离子晶体,离子所带电荷相同,离子半径I->Br->Cl->F-,故NaI、NaBr、NaCl、NaF的晶格能依次增大,离子晶体沸点升高,故C正确;
D.离子所带电荷相同,离子半径径Li+<Na+<K+<Rb+,金属键减弱,金属晶体的沸点降低,故D错误,
故选:C.
点评 本题考查晶体熔沸点高低比较,难度不大,注意理解掌握熔沸点高低比较规律,有利于基础知识的巩固.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
4.将一定质量的甲烷完全燃烧,将生成的气体依次通过装有足量无水CaCl2和NaOH的玻璃管中,结果盛NaOH的玻璃管的质量增加了2.2g.则原来通入的甲烷在标准状况下的体积为( )
| A. | 0.56L | B. | 1.12L | C. | 1.68L | D. | 2.24L |
8.某学生小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将酸式滴定管用蒸馏水洗净,用标准盐酸(0.1000mol/L)溶液润洗2遍,注入标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度;将锥形瓶用蒸馏水洗净后,也用该盐酸溶液润洗2遍;从酸式滴定管中放出20.00mL溶液到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,用待测NaOH溶液润洗2遍,调节滴定管尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度.
③向锥形瓶中滴入酚酞作指示剂,进行滴定并用pH计记录pH变化.滴定至指示剂刚好变色,且并不马上恢复原来颜色为止,记录碱式滴定管液面读数.再继续滴定,并记录pH至无明显变化为止.
重复上述取样、滴定工作2次,记录每次实验所用碱溶液体积.
回答下列问题:
(1)图1中有2根滴定管,其中b(选填“a”、“b”)是酸式滴定管.
(2)滴定过程中,边滴边摇动锥形瓶,眼睛应观察a(选填“a”、“b”).
a.锥形瓶内溶液颜色的变化 b.滴定管内液面的变化
(3)该小组在步骤①中有一个明显的错误操作,由此造成测定结果偏高 (选填“偏高”、“偏低”或“无影响”).
(4)图2中该滴定过程的滴定曲线是下列的a(选填“a”、“b”).

(5)有关数据记录如下:
则该小组计算得到NaOH溶液的物质的量浓度为0.10mol/L.
①将酸式滴定管用蒸馏水洗净,用标准盐酸(0.1000mol/L)溶液润洗2遍,注入标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度;将锥形瓶用蒸馏水洗净后,也用该盐酸溶液润洗2遍;从酸式滴定管中放出20.00mL溶液到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,用待测NaOH溶液润洗2遍,调节滴定管尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度.
③向锥形瓶中滴入酚酞作指示剂,进行滴定并用pH计记录pH变化.滴定至指示剂刚好变色,且并不马上恢复原来颜色为止,记录碱式滴定管液面读数.再继续滴定,并记录pH至无明显变化为止.
重复上述取样、滴定工作2次,记录每次实验所用碱溶液体积.
回答下列问题:
(1)图1中有2根滴定管,其中b(选填“a”、“b”)是酸式滴定管.
(2)滴定过程中,边滴边摇动锥形瓶,眼睛应观察a(选填“a”、“b”).
a.锥形瓶内溶液颜色的变化 b.滴定管内液面的变化
(3)该小组在步骤①中有一个明显的错误操作,由此造成测定结果偏高 (选填“偏高”、“偏低”或“无影响”).
(4)图2中该滴定过程的滴定曲线是下列的a(选填“a”、“b”).

(5)有关数据记录如下:
| 实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 2.00 | 22.00 |
| 3 | 20.00 | 1.00 | 20.80 |
15.下列关于${\;}_{2}^{3}He$的说法中正确的是( )
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
5.对于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
9.Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂.工业上制得的Na2S2O3•5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质.为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.(Na2S2O3+H2SO4γNa2SO4+SO2↑+S↓+H2O)
测得有关实验数据如下(标准状况):
(摩尔质量:Na2S2O3•5H2O 248g/mol; Na2SO3126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
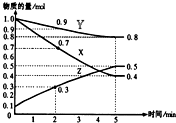 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.