题目内容
9.0.1mol•L-1下列溶液与0.2mol•L-1氢氧化钡溶液等体积混合,产生沉淀质量最大的是( )| A. | KAl(SO4)2 | B. | NH4Al(SO4)2 | C. | (NH4)2Fe(SO4)2 | D. | NH4Fe(SO4)2 |
分析 A.0.1mol•L-1的KAl(SO4)2与0.2mol•L-1氢氧化钡溶液等体积混合,Al3+与OH-刚好按1:4混合无沉淀;
B.0.1mol•L-1的NH4Al(SO4)2与0.2mol•L-1氢氧化钡溶液等体积混合,氢氧根先与铝离子结合成氢氧化铝,后再与铵根反应生成一水合氨;
C.0.1mol•L-1的(NH4)2Fe(SO4)2溶液与0.2mol•L-1氢氧化钡溶液等体积混合,氢氧根先与亚铁离子结合成氢氧化亚铁,后再与铵根反应生成一水合氨;
D.0.1mol•L-1的NH4Fe(SO4)2溶液与0.2mol•L-1氢氧化钡溶液等体积混合,氢氧根先与铁离子结合成氢氧化铁,后再与铵根反应生成一水合氨.
解答 解:A.0.1mol•L-1的KAl(SO4)2与0.2mol•L-1氢氧化钡溶液等体积混合,反应离子方程式为Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+AlO2-+H2O;
B.0.1mol•L-1的NH4Al(SO4)2与0.2mol•L-1氢氧化钡溶液等体积混合,反应离子方程式为NH4++Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+Al(OH)3↓+NH3•H2O;
C.0.1mol•L-1的(NH4)2Fe(SO4)2溶液与0.2mol•L-1氢氧化钡溶液等体积混合,反应离子方程式为2NH4++Fe2++2SO42-+4OH-+2Ba2+═2BaSO4↓+Fe(OH)2↓+2NH3•H2O;
D.0.1mol•L-1的NH4Fe(SO4)2溶液与0.2mol•L-1氢氧化钡溶液等体积混合,反应离子方程式为NH4++Fe3++2SO42-+4OH-+2Ba2+═2BaSO4↓+Fe(OH)3↓+NH3•H2O;
又因为质量m=n×M,BCD中沉淀物质的量相同,又氢氧化铁的摩尔质量>氢氧化亚铁>氢氧化铝,所以产生沉淀质量最大的是D;
故选D.
点评 本题考查了离子方程式的书写与计算,明确反应物量的关系以及反应的先后顺序是解本题关键,题目难度不大.

| A. | 1/5C2H2(g)+1/2O2(g)=2/5CO2(g)+1/5H2O(l)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)=0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol |
| A. | 0.56L | B. | 1.12L | C. | 1.68L | D. | 2.24L |
①将酸式滴定管用蒸馏水洗净,用标准盐酸(0.1000mol/L)溶液润洗2遍,注入标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度;将锥形瓶用蒸馏水洗净后,也用该盐酸溶液润洗2遍;从酸式滴定管中放出20.00mL溶液到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,用待测NaOH溶液润洗2遍,调节滴定管尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度.
③向锥形瓶中滴入酚酞作指示剂,进行滴定并用pH计记录pH变化.滴定至指示剂刚好变色,且并不马上恢复原来颜色为止,记录碱式滴定管液面读数.再继续滴定,并记录pH至无明显变化为止.
重复上述取样、滴定工作2次,记录每次实验所用碱溶液体积.
回答下列问题:
(1)图1中有2根滴定管,其中b(选填“a”、“b”)是酸式滴定管.
(2)滴定过程中,边滴边摇动锥形瓶,眼睛应观察a(选填“a”、“b”).
a.锥形瓶内溶液颜色的变化 b.滴定管内液面的变化
(3)该小组在步骤①中有一个明显的错误操作,由此造成测定结果偏高 (选填“偏高”、“偏低”或“无影响”).
(4)图2中该滴定过程的滴定曲线是下列的a(选填“a”、“b”).

(5)有关数据记录如下:
| 实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 2.00 | 22.00 |
| 3 | 20.00 | 1.00 | 20.80 |
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
| A. | 二氧化锰是催化剂,能加快反应速率 | |
| B. | 温度越高,催化剂的催化效果越好 | |
| C. | 食品包装袋中的抗氧化剂就是“负催化剂”,能使氧化还原反应的速率减慢 | |
| D. | 升高温度,吸热反应和放热反应的反应速率都加快 |
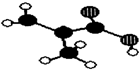 浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).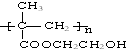 .
. 工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示:
工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示: