题目内容
3. 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.(1)下列四种化合物中含铜量最高的是a(填序号).
a.Cu2S b.Cu5FeS4 c.Cu2(OH)2CO3 d.CuFeS2
(2)2014年国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿冶炼得到,则需该铜矿的质量为3109.4万吨(保留一位小数).
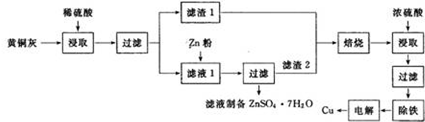
(3)为了充分利用铜资源,某工厂拟用黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜,并可得副产物锌盐,其生产流程如图:
回答下列问题:
①滤渣1的主要成分为Cu.
②滤液1加入Zn粉主要被还原的阳离子有Cu2+、Fe2+、H+(写离子符号).
③滤渣1及滤渣2需再进行焙烧,其原因是便于除去铜块内部包裹的锌等杂质;用浓硫酸二次浸取可能产生的有毒气体是SO2,净化的方法是用氨水吸收.
④除铁时,先加入稀硫酸及过氧化氢溶液将铁氧化为Fe3+,再调节pH,使铁形成Fe(OH)3沉淀除去.
⑤电解时,阴极的电极反应式为Cu2++2e-=Cu.电解后剩余电解液可循环利用,其方式是加入ZnO中和后与滤液2合并制备ZnSO4•7H2O.
分析 (1)含铜量=$\frac{所有铜的相对原子质量}{物质的含铜量}$;
(2)根据化学式Cu2S计算铜元素的质量分数,并计算一定质量的Cu2S物质中铜元素的质量,物质中某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比;
(3)黄铜灰中加入稀硫酸,稀硫酸可Zn、CuO、ZnO、FeO、Fe2O3反应,滤渣1为铜和少量的SiO2,滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入锌粉,锌粉可与Cu2+、Fe2+、H+反应生成铜和铁单质,滤渣2主要为铜和铁单质和过量的锌,焙烧便于除去铜块内部包裹的锌等杂质,浓硫酸与铜反应生成硫酸铜和二氧化硫,二氧化硫可用氨水吸收;电解硫酸铜溶液可得到铜单质,锌离子在溶液不放电,加入ZnO中和后与滤液2合并制备ZnSO4•7H2O.
解答 解:(1)a.Cu2S中含铜量为$\frac{128}{160}$=0.8;b.Cu5FeS4中含铜量为$\frac{320}{504}$=0.63;c.Cu2(OH)2CO3中含铜量为$\frac{128}{221}$=0.58;d.CuFeS2中含铜量为$\frac{64}{184}$=0.35,故答案为:a;
(2)Cu2S中铜元素的质量分数=$\frac{64×2}{160}$×100%=80%;则X吨含Cu2S 32%的铜矿石中含铜元素质量=Xt×80%×32%=796万t
解得X=3109.4万吨,故答案为:3109.4;
(3)①滤渣1为铜和少量的SiO2,主要成分为Cu,故答案为:Cu;
②锌粉可与Cu2+、Fe2+、H+反应生成铜和铁单质,被还原的阳离子有Cu2+、Fe2+、H+,故答案为:Cu2+、Fe2+、H+;
③焙烧便于除去铜块内部包裹的锌等杂质,浓硫酸与铜反应生成硫酸铜和二氧化硫,二氧化硫是酸性氧化物,可用氨水吸收,故答案为:便于除去铜块内部包裹的锌等杂质;SO2;用氨水吸收;
④氢氧化铁的溶解度比氢氧化亚铁小,将铁氧化为Fe3+,再调节pH,使铁形成Fe(OH)3沉淀除去,故答案为:调节pH;
⑤电解时,阴极得电子:Cu2++2e-=Cu;锌离子在溶液不放电,加入ZnO中和后与滤液2合并制备ZnSO4•7H2O,故答案为:Cu2++2e-=Cu;加入ZnO中和后与滤液2合并制备ZnSO4•7H2O.
点评 本题考查制备实验方案的设计,为高频考点,把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| 科学家 | 国籍 | 主要贡献 | |
| A | 贝采利乌斯 | 瑞典 | 首先提出“有机化学”和“有机化合物”的概念 |
| B | 维勒 | 德国 | 首次人工合成了有机物--尿素 |
| C | 李比希 | 法国 | 创立了有机物的定量分析方法 |
| D | 门捷列夫 | 俄国 | 发现元素周期律 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在一定体积和浓度的醋酸和氢氧化钠的混合液中一定存在:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) | |
| B. | 常温下pH=10的NaOH和NH3•H2O,加水稀释至pH=9,NaOH加水多 | |
| C. | 难溶电解质CaF2饱和溶液中,c(Ca2+)=amol/L,c(F-)=bmol/L,则Ksp=4ab | |
| D. | 0.1mol/L的碳酸钠溶液中,阴离子浓度大小顺序为:c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) |
| A. | 0.56L | B. | 1.12L | C. | 1.68L | D. | 2.24L |
| A. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | NH4Cl溶于重水(D2O)生成NH3D2O和HD2O+ | |
| D. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
①将酸式滴定管用蒸馏水洗净,用标准盐酸(0.1000mol/L)溶液润洗2遍,注入标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度;将锥形瓶用蒸馏水洗净后,也用该盐酸溶液润洗2遍;从酸式滴定管中放出20.00mL溶液到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,用待测NaOH溶液润洗2遍,调节滴定管尖嘴部分充满溶液,并使液面处于“0”或“0”以下刻度.
③向锥形瓶中滴入酚酞作指示剂,进行滴定并用pH计记录pH变化.滴定至指示剂刚好变色,且并不马上恢复原来颜色为止,记录碱式滴定管液面读数.再继续滴定,并记录pH至无明显变化为止.
重复上述取样、滴定工作2次,记录每次实验所用碱溶液体积.
回答下列问题:
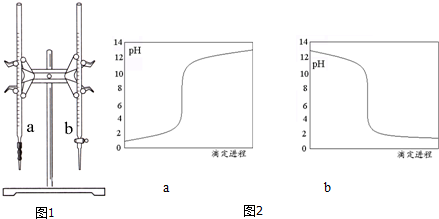
(1)图1中有2根滴定管,其中b(选填“a”、“b”)是酸式滴定管.
(2)滴定过程中,边滴边摇动锥形瓶,眼睛应观察a(选填“a”、“b”).
a.锥形瓶内溶液颜色的变化 b.滴定管内液面的变化
(3)该小组在步骤①中有一个明显的错误操作,由此造成测定结果偏高 (选填“偏高”、“偏低”或“无影响”).
(4)图2中该滴定过程的滴定曲线是下列的a(选填“a”、“b”).
(5)有关数据记录如下:
| 实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 2.00 | 22.00 |
| 3 | 20.00 | 1.00 | 20.80 |
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
| A. | 在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA | |
| B. | 1mol/LFeCl3 溶液中所含Fe3+的数目小于NA | |
| C. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| D. | 23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |