题目内容
4.煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳.然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的化学方程式为:
a.C(s)+O2(g)═CO2(g)△H=E1 ①
b.C(s)+H2O(g)═CO(g)+H2(g)△H=E2 ②
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=E3 ③
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=E4 ④
(1)途径b相比途径a有较多的优点,请写出其中一点:不仅可以大大减少SO2和烟尘对空气造成的污染,而且燃烧效率高,也便于运输;
(2)上述四个热化学方程式△H>0的是②(填写序号);
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是C
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为E1=E2+E3+E4.
分析 (1)固体煤经处理变成气体燃料后,可以大大减少SO2和烟尘对空气造成的污染,而且燃烧效率高;
(2)燃根据盖斯定律可知,反应一步完成或分步完成,其热效应相同;
(3)烧反应均为放热反应,C与水蒸气的反应为吸热反应;
(4)由盖斯定律可知:①=②+③+④,反应热也进行相应的计算.
解答 解:(1)固体煤经处理变成气体燃料后,不仅可以大大减少SO2和烟尘对空气造成的污染,而且燃烧效率高,也便于运输,
故答案为:不仅可以大大减少SO2和烟尘对空气造成的污染,而且燃烧效率高,也便于运输;
(2)①③④为燃烧反应,所以放热反应,②为吸热反应,故答案为:②;
(3)由盖斯定律可知,反应一步完成或分步完成,其热效应相同,则等质量的煤分别通过以上两条不同的途径产生的可利用的总能量相同,
故答案为:C;
(4)由盖斯定律可知:①=②+③+④,则能量为E1=E2+E3+E4,故答案为:E1=E2+E3+E4.
点评 本题考查盖斯定律、吸热反应与放热反应,题目较简单,注重对基础知识的理解掌握.

练习册系列答案
相关题目
14.糖类、蛋白质、油脂是人体重要的营养物质,下列有关说法不正确的是( )
| A. | 麦芽糖在人体内的水解产物能和银氨溶液发生反应 | |
| B. | 在鸡蛋清溶液中加入饱和的Na2SO4溶液时,会使蛋白质析出 | |
| C. | 淀粉、纤维素、蛋白质和油脂都是有机高分子化合物 | |
| D. | 在一定条件下氨基酸之间能发生反应,合成更复杂的化合物(多肽),构成蛋白质 |
15.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
| A. | 使用Cu-Zn-Fe催化剂可大大提高CH3CH2OH的产率 | |
| B. | 反应需在300℃进行可推测出该反应为吸热反应 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
12.下列关于元素周期表的说法正确的是( )
| A. | 短周期是指笫1、2周期 | B. | 过渡元素全部是金属元素 | ||
| C. | I A族的元索全部是金属元素 | D. | 元素周期表有8个副族 |
19.设NA伏加徳罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g N02和N204混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LC02与足量镁反应,转移电子的数目为0.4NA |
9.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有 0.4 mol电子转移,则在标准状况下消耗 4.48 L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
16.绿原酸的结构简式如图所示,下列有关绿原酸的说法不正确的是( )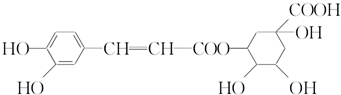
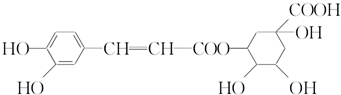
| A. | 分子式为C16H18O9 | |
| B. | 0.1 mol绿原酸最多与0.8 mol NaOH反应 | |
| C. | 能与Na2CO3反应 | |
| D. | 能发生取代反应和消去反应 |
13.短周期元素X、Y、Z在周期表中的相对位置如图所示,则下列说法正确的是( )
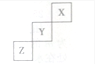

| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y是气态氢化物稳定性小于Z的气态氢化物 | |
| C. | Z一定是活泼的金属 | |
| D. | 1molZ单质在足量的氧气中燃烧时,有6mol电子发生转移 |
14.下列物质分別进行水解,其最终水解产物仅有一种的是( )
①蔗糖 ②麦芽糖 ③淀粉 ④纤维素 ⑤油脂 ⑥蛋白质.
①蔗糖 ②麦芽糖 ③淀粉 ④纤维素 ⑤油脂 ⑥蛋白质.
| A. | ①⑤⑥ | B. | ②③④⑤ | C. | ①③④⑥ | D. | ②③④ |