题目内容
9.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有 0.4 mol电子转移,则在标准状况下消耗 4.48 L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
分析 酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,正极应为O2得电子被还原,电极反应式为:O2+4e-+4H+═2H2O,正负极相加可得电池的总反应式为:CH3CH2OH+O2═CH3COOH+H2O,可根据电极反应式判断离子和电子的转移问题.
解答 解:A.原电池中,阳离子向正极移动,故A错误;
B.氧气得电子被还原,化合价由0价降低到-2价,若有0.4mol电子转移,则应有0.1mol氧气被还原,在标准状况下的体积为2.24L,故B错误;
C.酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,可知乙醇被氧化生成乙酸和水,总反应式为:CH3CH2OH+O2═CH3COOH+H2O,故C正确;
D.燃料电池中,氧气在正极得电子被还原生成水,正极反应式为:O2+4e-+4H+═2H2O,故D错误;
故选C.
点评 本题考查酸性乙醇燃料电池知识,题目难度中等,注意题中乙醇被氧化为乙酸的特点,答题中注意审题,根据题给信息解答.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
19.如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )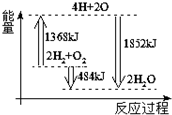

| A. | 由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 | |
| B. | 拆开2mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| C. | 2mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 | |
| D. | 2mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 |
20.下列反应对应的化学方程式或离子方程式,正确的是(反应条件略)( )
| A. | 铁和稀硝酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铝与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 醋酸跟碳酸氢钠溶液反应:HCO3-+H+═CO2↑+H2O | |
| D. | 乙醇的催化氧化:2C2H5OH+O2→2CH3CHO+2H2O |
17.若甲、丙为同主族元素的单质,乙、丁为氧化物,它们之间的转化关系为甲+乙→丙+丁,则满足条件的甲和丙为( )
| A. | 钠和氢气 | B. | 氯气和溴 | C. | 铝和铁 | D. | 碳和硅 |
1.将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )

| A. | 该温度下,反应的平衡常数数值约为7.36 | |
| B. | 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 | |
| C. | 反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol•L-1•s-1 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小 |
18.煤化工是以煤 为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工 产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
①实验1中以v(CO2) 表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸热(填“吸”或“放”)热反应
③该反应平衡常数的数学表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$表中x=$\frac{4}{3}$; y=$\frac{8}{3}$.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 3 | 0.75 | 2.25 | 3 |
| 3 | 900 | 2 | 4 | x | y | t |
②该反应的逆反应为吸热(填“吸”或“放”)热反应
③该反应平衡常数的数学表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$表中x=$\frac{4}{3}$; y=$\frac{8}{3}$.
19.下列有关叙述不正确的是( )
| A. | C02分子中σ键和π键之比为1:1 | |
| B. | PCl5中所有原子均满足8电子稳定结构 | |
| C. | 由于HCOOH分子间存在氢键,则同压下,HC00H的沸点比CH3OCH3的高 | |
| D. | CH2=CH-CHO分子中碳原子的杂化类型均为sp2 |

 .
.
 +2NaOH$→_{水}^{△}$
+2NaOH$→_{水}^{△}$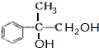 +2NaBr C→D
+2NaBr C→D E→Hn
E→Hn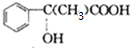 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$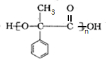 +(n-1)H2O
+(n-1)H2O 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式: 、
、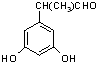 、
、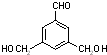 、
、 .
.