题目内容
15.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )| A. | 使用Cu-Zn-Fe催化剂可大大提高CH3CH2OH的产率 | |
| B. | 反应需在300℃进行可推测出该反应为吸热反应 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
分析 根据催化剂、温度、浓度对化学反应速率和化学平衡的影响来分析解答,并注意吸热反应与反应的条件无关.
解答 解:A、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,但催化剂不影响平衡移动,不能提高乙醇的产率,故A错误;
B、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故B错误;
C、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C正确;
D、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故D正确;
故选AB.
点评 本题考查化学反应速率和化学平衡知识,易错点为利用化学平衡知识判断反应吸热还是放热时,一定要注意温度的变化使反应正向移动还是逆向移动,倘若给出的信息为温度条件则无法判断,升高温度化学平衡向吸热的方向移动,而吸热反应取决于反应物与生成物总能量的相对大小.

练习册系列答案
相关题目
5.金属在生产、生活中的应用十分广泛.
I.某研究性学习小组在探究钠、镁、铝金属性强弱的过程中设计了以下探究性实验方案,请填写下列空白:
实验用品:酒精灯、烧杯、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、2mol•L-1的硫酸
方案如下表:
(1)写出实验a的反应的离子方程式:2Na+2H2O═2Na++2OH-+H2↑
(2)你认为a、b两步实验中出现异常现象的可能原因是:
a.钠表面的煤油没有用滤纸吸干净;
b.镁条表面的氧化膜没有被除去.
(3)下列措施不能提高镁条与硫酸反应产生氢气的速率的是AE
A.改用18mol•L-1的硫酸 B.加入少量硫酸铜
C.改用镁粉 D.升高温度 E.增大压强
Ⅱ.根据以上实验知道,镁比铝活泼,甲同学突发奇想,想设计一个原电池,让镁不腐蚀而铝腐蚀.请你帮他实现这个设想,在下面方框中画出装置图1,并写出负极电极反应式.
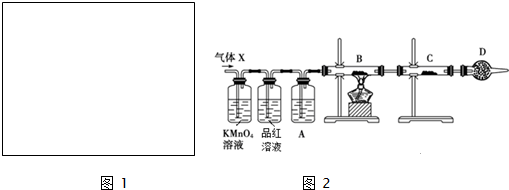
Ⅲ.工业上常用铝质容器盛装冷的浓硫酸,为研究铝质材料与热浓硫酸的反应,乙同学进行了以下探究活动:
(1)取铝片6.0g放入15.0mL浓硫酸中,加热,充分反应后收集到气体X.取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为50%.
(2)分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图2中夹持仪器省略).
①A中加入的试剂可能是浓硫酸
②若B中装氧化铜,C中装无水硫酸铜,则可以证明气体X中含有氢气的实验现象是B中固体由黑变红和C中固体由白变蓝.
I.某研究性学习小组在探究钠、镁、铝金属性强弱的过程中设计了以下探究性实验方案,请填写下列空白:
实验用品:酒精灯、烧杯、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、2mol•L-1的硫酸
方案如下表:
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a.取已切去表皮的一小块金属钠,放入盛有水的烧杯中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c.向两支盛有3mL 2mol•L-1硫酸的试管中加入大小相同的镁条和铝片 | 镁、铝与硫酸反应产生气泡剧烈程度不同 | 镁与硫酸反应产生气泡速率较快 |
(2)你认为a、b两步实验中出现异常现象的可能原因是:
a.钠表面的煤油没有用滤纸吸干净;
b.镁条表面的氧化膜没有被除去.
(3)下列措施不能提高镁条与硫酸反应产生氢气的速率的是AE
A.改用18mol•L-1的硫酸 B.加入少量硫酸铜
C.改用镁粉 D.升高温度 E.增大压强
Ⅱ.根据以上实验知道,镁比铝活泼,甲同学突发奇想,想设计一个原电池,让镁不腐蚀而铝腐蚀.请你帮他实现这个设想,在下面方框中画出装置图1,并写出负极电极反应式.

Ⅲ.工业上常用铝质容器盛装冷的浓硫酸,为研究铝质材料与热浓硫酸的反应,乙同学进行了以下探究活动:
(1)取铝片6.0g放入15.0mL浓硫酸中,加热,充分反应后收集到气体X.取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为50%.
(2)分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图2中夹持仪器省略).
①A中加入的试剂可能是浓硫酸
②若B中装氧化铜,C中装无水硫酸铜,则可以证明气体X中含有氢气的实验现象是B中固体由黑变红和C中固体由白变蓝.
6.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 常温常压下,17g烃基含有的电子总数为9N | |
| C. | 标准状况下,11.2LCH2CI2中含有的共价键数目为2N. | |
| D. | CH2=CH2和CH2=CHCH3的混合气体28g,完全燃烧后生成的CO2分子数目为2.5N |
10.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| D. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃 |
20.下列反应对应的化学方程式或离子方程式,正确的是(反应条件略)( )
| A. | 铁和稀硝酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铝与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 醋酸跟碳酸氢钠溶液反应:HCO3-+H+═CO2↑+H2O | |
| D. | 乙醇的催化氧化:2C2H5OH+O2→2CH3CHO+2H2O |
5.(1)胆矾CuSO4•5H2O的结构示意图1如下,其含有的微粒间作用力有abde(填序号)
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(2)根据等电子原理,写出与CO2等电子体的分子和离子各一种N2O或CS2、CNO-或SCN-或NO2+;1molO22+中含有的π键数目为2NA
(3)已知
分析表中四种物质的相关数据,请回答
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3
(4)C60形成晶体的晶胞结构如图2所示,则每个C60分子周围距离最近的C60分子由12个,若晶胞参数为pnm,列出计算该晶体的密度$\frac{4×720}{(p×1{0}^{-7})^{3}{N}_{A}}$g•cm-3(阿伏伽德罗常数用NA表示)
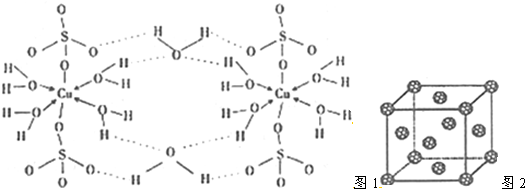
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(2)根据等电子原理,写出与CO2等电子体的分子和离子各一种N2O或CS2、CNO-或SCN-或NO2+;1molO22+中含有的π键数目为2NA
(3)已知
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3
(4)C60形成晶体的晶胞结构如图2所示,则每个C60分子周围距离最近的C60分子由12个,若晶胞参数为pnm,列出计算该晶体的密度$\frac{4×720}{(p×1{0}^{-7})^{3}{N}_{A}}$g•cm-3(阿伏伽德罗常数用NA表示)
