题目内容
【题目】已知![]() (X)、
(X)、![]() (Y)互为同分异构体,下列说法不正确的是
(Y)互为同分异构体,下列说法不正确的是
A. Y的一氯代物只有三种
B. X的所有原子可能处于同一平面
C. X、Y与足量氢气完全加成时所需氢气的物质的量之比为1:1
D. X、Y均可使溴的水溶液褪色,且褪色的原理相同
【答案】C
【解析】
考查有机物的基础知识,涉及等效氢的判断、共面、共线、官能团的形式等知识,应从各有机物代表物入手进行分析;
A、 ,该有机物有3种不同的氢原子,因此一氯代物有3种,故A说法正确;
,该有机物有3种不同的氢原子,因此一氯代物有3种,故A说法正确;
B、苯环空间构型为平面正六边形,CH2=CH2属于平面结构,由于碳碳单键可以旋转,因此X中所有原子可能处于同一平面,故B说法正确;
C、1mol苯环与氢气发生加成,最多消耗3molH2,1mol“C=C”最多消耗1molH2,1个X分子中含有1个苯环和1个“C=C”,因此1molX最多消耗4molH2,1molY最多消耗3molH2,因此所需氢气的物质的量之比为4:3,故C说法错误;
D、根据结构简式,X和Y中都含有“C=C”,与溴水发生加成反应,且溴水褪色的原理相同,故D说法正确。

【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。

(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
【题目】实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如下:
甘氨酸((NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制备FeCO3:向配制好的FeSO4溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
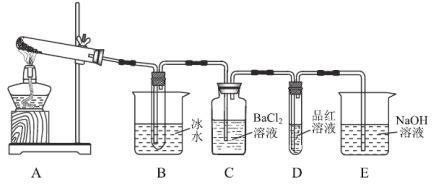
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀(过量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排尽,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥后得到产品。

回答下列问题:
(1)仪器P的名称是_______。
(2)实验Ⅰ配制FeSO4溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(填化学式)。
(3)实验Ⅱ中,生成沉淀的离子方程式为_____。
(4)实验Ⅲ中,
①检查装置A的气密性的方法是______。
②柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
pH过低会使产率下降,其原因是______;柠檬酸的作用还有_____(填字母)。
A.作催化剂
B.作反应终点指示剂
C.促进FeCO3溶解
D.防止二价铁被氧化
③洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_____(填字母)。
A.热水 B.稀硫酸
C.乙醇 D.柠檬酸溶液
(5)若产品的质量为16.32g,则产率为_____。
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
⑴ 铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
⑵ 基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag(填“>”或“<”)。
⑶ [Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
⑷ 用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
⑸氯、铜两种元素的电负性如表:
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
CuCl属于________(填“共价”或“离子”)化合物。

⑹Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为_____(用含ρ、a的代数式表示,相对原子质量:Cu-64,Cl-35.5)。