��Ŀ����
����Ŀ��������ʾ��dz��ɫ��FeSO4��7H2O����ʧˮΪFeSO4��H2Oʱ�ʰ�ɫ����FeSO4ʱΪ��ɫ���塣FeSO4�����ȿɷֽ�ΪFeO��SO3����ǿ�ȿɷֽ�ΪFe2O3��SO3��SO2��SO3���۵�Ϊ16.8�����е�Ϊ44.8������ѧ��ȤС����������Ͻ���ʵ��̽����
��һ�������̷�����ˮ����������
��1����ҩƷװ��������д���ƣ�____�н��м��ȣ��ѽ��ᾧˮ�����������ǣ�ѡ����ţ�___��
A���۲���ˮ�������� B�������ز���������γ������õ���������ȫ��ͬ
C��������ȫ��Ϊ��ɫ D�������ز���������������������ƽ�������
�ڶ�����ȡһ������ˮ��������������ͼ�����ּг�������ȥ����ʾA���Թ��н��м��ȡ�
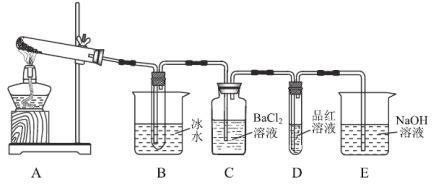
��2��ʵ�������C��D��E�г�������������������������������B�Թ��в�����������������ˮ���������Һ�е������ӵķ����ǣ�___��ʵ������л���һ�����Ե������ǣ�________________��
�����������ڶ���ʵ���װ����A��B���ָ�Ϊ��ͼ��ʾ��![]() ��
��![]() ��C��D��E���䣨C��E�ж�װ��������Һ����
��C��D��E���䣨C��E�ж�װ��������Һ����
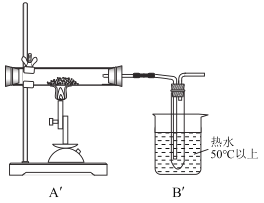
ͬ��ȡһ������ˮ������������![]() ��ʯӢ�������н��м��ȣ���Ӧ��Ϻ�ʯӢ�������������������ž����۲쵽C�в�����ɫ������D�Թ�����Һ��ɫ��
��ʯӢ�������н��м��ȣ���Ӧ��Ϻ�ʯӢ�������������������ž����۲쵽C�в�����ɫ������D�Թ�����Һ��ɫ��
��3��ʵ����![]() �IJ������е������ǣ�______��˵��
�IJ������е������ǣ�______��˵��![]() װ�õ�һ�������ǣ�________��
װ�õ�һ�������ǣ�________��
���C��Һ����ȫȡ�����й��ˡ�ϴ�ӡ�����Ƶ����ù�������Ϊ23.300g��������Һ��ˮϡ�Ͷ���Ϊ1L��ȡ��20.00mL������ƿ�У�����֪Ũ�ȵı�NaOH��Һ�ⶨ��1L��Һ��һ�����ʵ�Ũ�ȡ�
��4������ʵ��������õ��Ķ���������_______���õ���ָʾ����_______��
��5����������Һ��ˮ����ʱ����ˮ���õ���������Ϊ_____����ȥ����![]() �������в������������Ӧ�ӽ���____g��
�������в������������Ӧ�ӽ���____g��
���𰸡����� D ȡ���������Ȼ�����Һ������ɫ������������������� A���Թ�����ɫ�����Ϊ��ɫ��ĩ ��ɫ�����Ϊ��ɫ��ĩ ��ֹC����Һ������![]() �������У����ֹSO3������Һ̬���̬�� 1000mL����ƿ���ζ��ܡ�������ƽ ��̪��Һ ��ͷ�ι� 16.000g
�������У����ֹSO3������Һ̬���̬�� 1000mL����ƿ���ζ��ܡ�������ƽ ��̪��Һ ��ͷ�ι� 16.000g
��������
�������⣬�̷���FeSO4��7H2O������ʧˮΪFeSO4��H2Oʱ�ʰ�ɫ����FeSO4ʱΪ��ɫ���塣FeSO4�����ȿɷֽ�ΪFeO��SO3����ǿ�ȿɷֽ�ΪFe2O3��SO3��SO2������SO42-�ķ����ǣ�ȡ���������Ȼ�����Һ������ɫ������������������ӣ�C�зֽ����ɵ�SO3��BaCl2��Һ��Ӧ�������ᱵ���������ᣬ�Դ˽��з������
��1�����չ�����Ҫ�������н��У�����ʧˮ���������ù���ɷ�ΪFeSO4����������γ��������������ƽ���������ȷ�����ᾧˮ�ѳ�������ѡD������ѡ�������ȷ��
��ˣ�������ȷ���ǣ�������D��
��2��FeSO4�����ȿɷֽ�ΪFeO��SO3����ǿ�ȿɷֽ�ΪFe2O3��SO3��SO2��ʵ�������C��D��E�г���������������������������˵��û����SO2��B�Թ��в�������������ΪSO3������ˮ�õ����ᣬ����SO42-�ķ����ǣ�ȡ���������Ȼ�����Һ������ɫ������������������ӣ�FeSO4�����ȿɷֽ�ΪFeO��SO3��FeOΪ��ɫ��ĩ����A���Թ�����ɫ�����Ϊ��ɫ��ĩ��
��ˣ�������ȷ���ǣ�ȡ���������Ȼ�����Һ������ɫ������������������ӣ�A���Թ�����ɫ�����Ϊ��ɫ��ĩ��
��3��FeSO4��ǿ�ȿɷֽ�ΪFe2O3��SO3��SO2��ʵ����![]() �IJ������е������ǣ���ɫ�����Ϊ��ɫ��ĩ��
�IJ������е������ǣ���ɫ�����Ϊ��ɫ��ĩ��![]() װ�õ��Թ�����ˮԡ���ȣ�������ȫƿ�����ã���ֹC����Һ������
װ�õ��Թ�����ˮԡ���ȣ�������ȫƿ�����ã���ֹC����Һ������![]() �������У�Ҳ���Է�ֹSO3������Һ̬���̬��
�������У�Ҳ���Է�ֹSO3������Һ̬���̬��
��ˣ�������ȷ���ǣ���ɫ�����Ϊ��ɫ��ĩ����ֹC����Һ������![]() �������У����ֹSO3������Һ̬���̬����
�������У����ֹSO3������Һ̬���̬����
��4��C�зֽ����ɵ�SO3��BaCl2��Һ��Ӧ�������ᱵ���������ᣬ���˳�������ϴ�ӡ����������������Һ�������ᣬ��ˮϡ�Ͷ���Ϊ1L��ȡ��20.00mL������ƿ�У�����֪Ũ�ȵı�NaOH��Һ�ⶨ�����ϲ����õ��Ķ���������1000mL����ƿ���ζ��ܡ�������ƽ����NaOH�������ѡ�÷�̪Ϊָʾ����
��ˣ�������ȷ���ǣ�1000mL����ƿ���ζ��ܡ�������ƽ����̪��Һ��
��5������ʱ��ˮ���õ���������Ϊ��ͷ�ιܣ�
�ɷ�Ӧʽ2FeSO4![]() Fe2O3+SO3��+SO2����֪�����ɵ����ʵ�����Fe2O3��SO3��
Fe2O3+SO3��+SO2����֪�����ɵ����ʵ�����Fe2O3��SO3��
����SO3~BaSO4���ɼ����n(Fe2O3)=n(SO3)=n(BaSO4)=![]() =0.1000mol��
=0.1000mol��
![]() �������в�������ΪFe2O3��������ӦΪ0.1000mol��160g/mol=16.000 g��
�������в�������ΪFe2O3��������ӦΪ0.1000mol��160g/mol=16.000 g��
��ˣ�������ȷ���ǣ���ͷ�ιܣ�16.000g��