题目内容
【题目】实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如下:
甘氨酸((NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制备FeCO3:向配制好的FeSO4溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
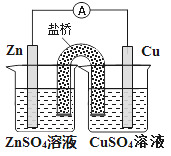
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀(过量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排尽,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥后得到产品。

回答下列问题:
(1)仪器P的名称是_______。
(2)实验Ⅰ配制FeSO4溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(填化学式)。
(3)实验Ⅱ中,生成沉淀的离子方程式为_____。
(4)实验Ⅲ中,
①检查装置A的气密性的方法是______。
②柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
pH过低会使产率下降,其原因是______;柠檬酸的作用还有_____(填字母)。
A.作催化剂
B.作反应终点指示剂
C.促进FeCO3溶解
D.防止二价铁被氧化
③洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_____(填字母)。
A.热水 B.稀硫酸
C.乙醇 D.柠檬酸溶液
(5)若产品的质量为16.32g,则产率为_____。
【答案】恒压漏斗(答分液漏斗也给分) Fe Fe2++2HCO3-═FeCO3↓+CO2↑+H2O 关闭弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中的液面差保持不变,说明装置不漏气(答案合理即可) H+会与NH2CH2COOH反应 CD C 80%
【解析】
弄清楚实验目的,实验目的是制备甘氨酸亚铁,理解实验原理,实验原理是FeCO3在柠檬酸的作用下与甘氨酸反应,Fe2++2NH2CH2COOH=(NH2CH2COO)2Fe,然后针对问题展开而分析。
(1)根据仪器P的特点,仪器P为恒压漏斗或恒压滴液漏斗;
(2)Fe2+容易被氧气氧化,同时Fe+2Fe3+=3Fe2+,不引入杂质,因此保存FeSO4时,应加入的试剂为Fe;
(3)FeSO4溶液中加入NH4HCO3溶液发生反应,产物是FeCO3和CO2,其离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(4)①检验装置A的气密性,其方法是关闭弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中的液面差保持不变,说明装置不漏气;
②-NH2显碱性,pH过低时,H+能与-NH2发生反应,产率降低;柠檬酸有强酸性,能使FeCO3溶解,作用之一是调节pH促进FeCO3溶解,根据信息,柠檬酸具有还原性,可防止Fe2+被氧化,因此选项CD符合题意;
③甘氨酸亚铁易溶于水,难溶于乙醇,因此选择乙醇溶液作为洗涤剂,故选项C正确;
(5)根据步骤Ⅲ,FeCO3过量,根据甘氨酸计算(NH2CH2COO)2Fe的质量,关系式为2NH2CH2COOH~(NH2CH2COO)2Fe,即甘氨酸亚铁的理论质量为0.2mol×204g·mol-1/2=20.4g,产率=实际产量/理论产量×100%=16.32/20.4×100%=80%。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相 中经自由基偶联反应生成乙烯,其反应如下:2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=_____________ (用含a.b.c.d的代数式表示)。

(1)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂 时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(选填“〉”、“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液在25 0C时pH=_______ (假设电解前后NaCl溶液的体积均为500 mL)。
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。