��Ŀ����
����Ŀ���˰�ȫ���������Ⱦ����������㷺��ע���ڱ�ը�ĺ˵�վ��Χ���з��������� ��-131��-137����-131 �������������룬���ܻ�������״���״�ȼ�����
(1)����ͬ�����ǰ������(������������)������Ԫ��X��Y��Z�ĵ�һ���������±���
Ԫ�ش��� | X | Y | Z |
��һ������/(kJ.mol) | 520 | 496 | 419 |
��̬Zԭ�ӵ����ڶ�����ӵ��Ų�ʽΪ______��X��Y��Z����Ԫ���γɵĵ����۵��ɸߵ��͵�˳��Ϊ_______(��Ԫ�ط��ű�ʾ)����ԭ��Ϊ___________ .
(2)F��Iͬ����,BeF2��������ԭ�ӵ��ӻ�����Ϊ_________ ,BeF2������________����(ѡ���������������Ǽ�����)��
(3)��֪�ߵ�����������ʽ,��ѧʽ�ֱ�ΪH5IO6  ��HIO4 ,��������ǿ��˳��Ϊ:H5IO6 ________HIO4(ѡ��">"��"<"��=��)���ӵ����Ƶ��ص���ʽ�ĽǶȷ���,H5IO6�����еĻ�ѧ����________(д������).
��HIO4 ,��������ǿ��˳��Ϊ:H5IO6 ________HIO4(ѡ��">"��"<"��=��)���ӵ����Ƶ��ص���ʽ�ĽǶȷ���,H5IO6�����еĻ�ѧ����________(д������).
(4)131I2����ľ����ṹ��ͼ����ʾ���þ�����ƽ������________��131Iԭ�ӣ������е���ӵ�������_________�ֲ�ͬ�ķ���

(5)KI�ľ����ṹ��ͼ����ʾ��ÿ��K����Χ���ڵ�K������Ϊ_______����KI������ܶ�Ϊ��g.cm-3 ,K��I��ԭ�Ӱ뾶�ֱ�Ϊrkcm��rI cm,�����ӵ�������ֵΪNA,�� KI�����еĿռ�������Ϊ_______. �ۿռ�������=(�����/�������)��100%,�������ĸ�Ĵ���ʽ��ʾ���ɣ�
���𰸡�3s23p6 Li��Na��K ﮡ��ơ��ؾ�Ϊ�������壬���ǵļ۵�������ȣ��������������ĵ������ͬ�����Ӱ뾶���������������μ��������۵����ν��� sp �Ǽ��� �� ������ 8 2 12 ![]() ��100%
��100%
��������
��1������ͬ���弴��A�壬ǰ�����ڵ�Ԫ�طֱ�ΪH��Li��Na��K�������ṩ��X��Y�ĵ�һ�����ܵIJ�ֵ��Y��Z�ĵ�һ�����ܵIJ�ֵ�����֪��X��Y��Z��������HԪ�أ���ͬ����Ԫ�����ŵ��Ӳ��������ӣ���һ��������С����X��Y��Z�ֱ�ΪLi��Na��K��Kԭ�Ӻ˵����Ϊ19��д����������Ų�ʽ���ﮡ��ơ���Ϊ�������壬�Ƚ��۷е�Ҫ�Ƚ����Ӱ뾶��������ɣ�
��2���ӻ������ɳɼ����ӶԺµ��ӶԾ�����BeF2���ӳɼ����Ӷ�Ϊ2���µ��Ӷ�Ϊ0���ݴ˷�������
��3���ȽϺ���������Դ�С��ͨ���ȽϺ����ǻ���ԭ�Ӹ�����H5IO6��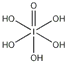 �������ǻ���ԭ��1����HIO4�����ǻ���ԭ��3����������1���������ɣ�˫����1��������1���������ɣ�
�������ǻ���ԭ��1����HIO4�����ǻ���ԭ��3����������1���������ɣ�˫����1��������1���������ɣ�
��4�����ݾ�̯��������I2�ھ�����8�������6�����ϣ�������8�������������һ��ȡ���������ǰ����һ��ȡ��
��5��KI������NaCl�����ṹ���ƣ�ÿ��K+����K+����ĶԽ����ϣ��ռ�������=(�����/�������)��100%��������Ҫ�ֱ����������ԭ����ռ������;���������������=4/3��r3���������=m/�����ݴ˷�������
��1�����ݵ����ܵ�����X��Y��Z��������HԪ�أ���ͬ����Ԫ�����ŵ��Ӳ��������ӣ���һ��������С����X��Y��Z�ֱ�ΪLi��Na��K��Kԭ�Ӻ˵����Ϊ19����������Ų�ʽΪ1s22s22p63s23p64s1�������ڶ�����ӵ��Ų�ʽΪ3s23p6��Li��Na��K����������������1�������Ӱ뾶�����������������۵㽵�͡��𰸣�3s23p6��Li��Na��K��ﮡ��ơ��ؾ�Ϊ�������壬���ǵļ۵�������ȣ��������������ĵ������ͬ�����Ӱ뾶���������������μ��������۵����ν��ͣ�
��2��BeF2����������ԭ��ΪBe����۵�����Ϊ2��F�ṩ2�����ӣ�����Beԭ�ӵļ۲���Ӷ���Ϊ��2+2��/2=2��Beԭ�ӵ��ӻ�����Ϊsp�ӻ������ӹ���Ϊֱ���Σ��ǷǼ��Է��ӡ��𰸣�sp���Ǽ��ԣ�
��3��H5IO6�� ���к���5���ǻ��⣬Ϊ��Ԫ�ᣬ�����ǻ���ԭ��1����HIO4ΪһԪ�ᣬ����1���ǻ��⣬�����ǻ���ԭ��3�����������ԣ�H5IO6��HIO4��H5IO6��
���к���5���ǻ��⣬Ϊ��Ԫ�ᣬ�����ǻ���ԭ��1����HIO4ΪһԪ�ᣬ����1���ǻ��⣬�����ǻ���ԭ��3�����������ԣ�H5IO6��HIO4��H5IO6�� ���д���˫�������Է����еĻ�ѧ���Цļ����м����𰸣�������������
���д���˫�������Է����еĻ�ѧ���Цļ����м����𰸣�������������
��4���ɵ⾧����֪��I2�ھ�����8�������6�����ϣ���һ�������к���4��I2���ӣ���8��Iԭ�ӣ��۲�⾧��ͼʾ��֪�������е���ӵ�������2�֡��𰸣� 8��2��
��5��KI������NaCl�����ṹ���ƣ�ÿ��K+����12��K+�����ݾ�̯�����㣬K��8��1/8+6��1/2��4��I��12��1/4+1=4�����侧����ԭ����ռ�����V1=![]() �����������V2=m/��=[4��(39+127)]/NA������KI������ԭ�ӵ����ռ��������İٷ���ΪV1/V2��100%=
�����������V2=m/��=[4��(39+127)]/NA������KI������ԭ�ӵ����ռ��������İٷ���ΪV1/V2��100%=![]() ��100%���𰸣�12��
��100%���𰸣�12��![]() ��100%��
��100%��

����Ŀ���п�Ժһ�����³ɹ�ʵ���˼����Ч������ϩ�������ڴ�����������,������ �о����ɻ�ż����Ӧ������ϩ���䷴Ӧ���£�2CH4(g) ![]() C2H4(g) +2H2(g) ��H>0
C2H4(g) +2H2(g) ��H>0
��ѧ�� | H��H | C��H | C = C | C��C |
E(kJ / mol) | a | b | c | d |
(1)��֪��ػ�ѧ���ļ������ϱ��������Ʊ���ϩ��Ӧ����H=_____________ (�ú�a.b.c.d�Ĵ���ʽ��ʾ)��

(1)T1�¶�ʱ����1 L�ĺ��ݷ�Ӧ���г���2 molCH4 ,������������Ӧ����Ӧ������ 0~15 min CH4�����ʵ�����ʱ��仯��ͼ,���10-15 minʱH2��Ũ��Ϊ1.6 mol/L��
��0~ 10 min��CH4��ʾ�ķ�Ӧ����Ϊ____mol/(Lmin) o
����ͼ������a������b�ֱ��ʾ���¶�T1ʱ��ʹ��������ͬ���������ͬ�Ĵ��� ʱ���ﵽƽ�������n (CH4)�仯���ߣ����б�ʾ����������ϴ�������� ________ (��"a"�� ��b��)��
��15 minʱ,���ı���練Ӧ����,����n( CH4)����ͼ����ʾ�仯����ı������������_____(�δ�һ������)��
(3)ʵ����v��=k��c2(CH4),v��=k��c(C2H4).c2(H2) ����K����K��Ϊ���ʳ��������¶��йأ�T1�¶�ʱk����K���ı�ֵΪ______ (����ֵ)�������¶���T1���ߵ�T2,��Ӧ��������ı���V�� ____V��(ѡ������������=����<��)���жϵ�������__________
(4)������Ա����˼���ȼ�ϵ�ز����ڵ�⡣��ͼ��ʾ��������Dz����� Y2O3�� ZrO2�Ĺ��壬���ڸ����´���O2-
��C����PtΪ_______ ��(ѡ���������������� )��
�ڸõ�ع���ʱ������Ӧ����ʽΪ_____________________ ��
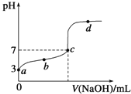
���øõ�ص�ⱥ��ʳ��ˮ��һ��ʱ����ռ�����������������Ϊ112 mL,��������������Һ��25 0CʱpH=_______ (������ǰ��NaCl��Һ�������Ϊ500 mL)��