题目内容
14.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
| A. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 | |
| B. | 常温下,NO分解产生O2的反应的平衡常数表达式为K1=[N2]•[O2] | |
| C. | 常温下,2H2O(g)═2H2 (g)+O2(g),此时平衡常数的数值约为5×10-82 | |
| D. | 以上说法都不正确 |
分析 A.根据化学平衡常数K的数值越大,化学反应进行的程度越大;
B.化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值;
C.根据方程式的书写反写,平衡常数是原来的倒数;
D.根据ABC选项的情况回答.
解答 解:A.常温下,NO、H2O、CO2三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>H2O>CO2,故A正确;
B.常温下,NO分解产生O2的反应的平衡常数表达式式K1=$\frac{c({N}_{2})c({O}_{2})}{{c}^{2}(NO)}$,故B错误;
C.2H2(g)+O2(g)?2H2O(g) K2=2×1081,所以2H2O(g)?2H2(g)+O2(g) K3=$\frac{1}{2×1{0}^{81}}$=5×10-82,故C正确;
D.因C正确,故D错误;
故选C.
点评 本题考查的是化学平衡常数的相关知识,化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值,题目难度中等.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案
相关题目
4.下列有关说法错误的是( )
| A. | H2O2、Na2O2都属于过氧化物、都存在非极性共价键 | |
| B. | H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 | |
| C. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| D. | H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |
19.有人设想合成具有以下结构的烃分子,下列说法不正确的是( )
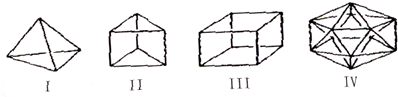

| A. | Ⅳ不可能合成得到 | B. | Ⅱ与苯互为同分异构体 | ||
| C. | Ⅲ(立方烷)的六氯代物共有3种 | D. | Ⅰ中各键之间夹角为109°28′ |
6.下列叙述正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 任何物质的摩尔质量就等于它的相对分子质量或相对原子质量 | |
| C. | 物质的量实质上是物质的质量 | |
| D. | 1mol H2SO4中含有2mol H、1mol S和4mol O |
3.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
| A. | 氧化产物与还原产物的粒子个数比为5:2 | |
| B. | 氧化产物与还原产物的粒子个数比为2:5 | |
| C. | 氧化剂与还原剂的粒子个数之比为1:8 | |
| D. | 氧化剂与还原剂的粒子个数之比为1:5 |
4.用NA表示阿伏加德罗常数的值,下列有关说法不正确的是( )
| A. | 标准状况下,22.4LN2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2g H2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子 | |
| D. | 1L1mol•L-1的氨水,含NA个NH3•H2O |
