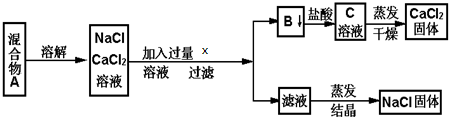
题目内容
2.某工厂的燃料煤中硫的质量分数为0.32%,该工厂每天燃烧这种煤100 t.计算:(1)如果煤中的硫全部转化为SO2,每天可产生的SO2的质量;
(2)这些SO2在标准状况下的体积.
分析 (1)根据硫元素守恒计算;
(2)根据n=$\frac{m}{M}$计算二氧化硫物质的量,再根据V=nVm计算二氧化硫体积.
解答 解:(1)设每天可产生的SO2的质量为xt,根据硫元素守恒:
100t×0.32%=xt×$\frac{32}{64}$
解得x=0.64
答:每天可产生的SO2的质量为0.64吨;
(2)二氧化硫物质的量为$\frac{640000g}{64g/mol}$=10000mL,故二氧化硫的体积为10000mol×22.4L/mol=2.24×105L,
答:SO2在标准状况下的体积为2.24×105L.
点评 本题考查化学方程式计算,注意利用守恒法计算,难度不大,旨在考查学生对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.与二氧化硫反应时,下列物质作氧化剂的是( )
| A. | 溴单质 | B. | 硫化氢 | C. | 品红 | D. | 氢氧化钙 |
10.有下列变化按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是( )
①大气固氮
②硝酸银分解
③实验室制取氨气.
①大气固氮
②硝酸银分解
③实验室制取氨气.
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ③①② |
17.对于氮、磷、砷元素的下列说法中,正确的是( )
| A. | 最高价氧化物的水化物酸性减弱的顺序是HNO3、H3PO4、H3AsO4 | |
| B. | 气态氢化物的水溶液碱性增强的顺序是NH3、PH3、AsH3 | |
| C. | 随着核电荷数的增大,其原子半径减小 | |
| D. | 随原子序数增大,气态氢化物的稳定性增强 |
14.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
| A. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 | |
| B. | 常温下,NO分解产生O2的反应的平衡常数表达式为K1=[N2]•[O2] | |
| C. | 常温下,2H2O(g)═2H2 (g)+O2(g),此时平衡常数的数值约为5×10-82 | |
| D. | 以上说法都不正确 |
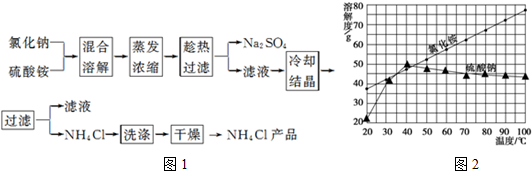
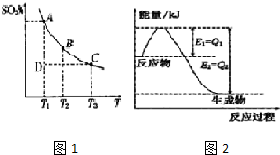
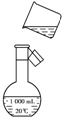 实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.
实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.