题目内容
足量Zn粉与50ml、 0.1mol/L的稀硫酸充分反应。为了减慢此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加Na2SO4溶液;②改用50ml、0.1mol/L的稀盐酸;③改用50ml、0.05mol/L的硝酸;
④加适量固体醋酸钠;⑤减压;⑥冰水浴;⑦加NaCO3溶液;⑧纯Zn改为不纯的Zn
| A.①④⑥ | B.③⑤⑥⑦⑧ | C.①②⑤⑥ | D.全部 |
A
解析试题分析: 影响化学反应速率的因素有温度,浓度,压强,催化剂,固体反应物的接触面积,硫酸与锌反应的实质是氢离子与锌反应生成锌离子和氢气,故
①加Na2SO4溶液相当于稀释反应物硫酸的浓度,故反应速率减慢,但不改变氢气的产量。②改用50ml、0.1mol/L的稀盐酸会增加氢离子浓度,会改变增大产生氢气的量。故②错。;③改用50ml、0.05mol/L的硝酸;硝酸与锌反应不产生氢气,故③错。④加适量固体醋酸钠,醋酸根离子可以与氢离子形成弱酸醋酸,可以减慢化学反应的速率,但不改变氢气的量,故④正确,⑤减压,减压向体积增大的方向进行即向正反应方向,会加快产生氢气的速率,故⑤错。⑥冰水浴相当于降低温度,反应速率会减慢,故⑥正确。;⑦加NaCO3溶液中的碳酸根离子会消耗溶液中一部分的氢离子,会改变氢气的产量故⑦错,
⑧纯Zn改为不纯的Zn,可形成微小原电池,加快反应速率的进行,故⑧错。
考点:考查影响化学反应速率因素的相关知识点。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案(15分)
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为 。
②下列选项能判断该反应达到平衡状态的依据的有____ 。
A. | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
 (3)已知在常温常压下:
(3)已知在常温常压下: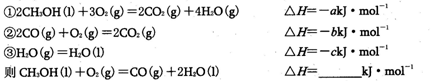
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为____
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.

电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 。
除去杂质后的水煤气主要含H2、CO,是理想的合成甲醇的原料气。
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g)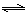 2CO(g) △H1;
2CO(g) △H1;
②CO(g)+H2O(g)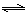 H2(g)+CO2(g) △H2;③C(s)+H2O(g)
H2(g)+CO2(g) △H2;③C(s)+H2O(g)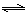 CO(g)+H2(g) △H3;
CO(g)+H2(g) △H3;
上述反应△H3与△H1、△H2之间的关系为 。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:2CH4(g)+3O2(g) 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)请在答题卡中,画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(4)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.20 | 0.10 | 0.40 |
①该时间段内平均反应速率v(H2)= 。
②比较此时正、逆反应速率的大小:v(正) v (逆)(填“>”、“<”或“=”)
(5)生产过程中,合成气要进行循环,其目的是 。
某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体 g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母) 。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示: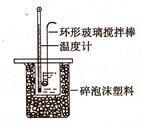
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/ml,中和后生成溶液的比热容
C=4.18J/(g.℃)。则中和热△H= (取小数点后一位)。
③上述实验结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
恒温恒容的容器内,不可作为可逆反应I2(g)+H2(g) 2HI(g)达到平衡状态的标志的是
2HI(g)达到平衡状态的标志的是
| A.1 mol H—H键断裂,同时有2 mol H—I键断裂 | B.容器内气体的总压强不再变化 |
| C.H2的物质的量浓度不再变化 | D.混合气体的颜色不再变化 |
一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)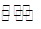 2NH3(g),能说明该反应达到化学平衡状态的是 ( )
2NH3(g),能说明该反应达到化学平衡状态的是 ( )
| A.N2、H2、NH3的浓度相等 |
| B.N2、H2、NH3的浓度不再变化 |
| C.N2、H2、NH3在密闭容器中共存 |
| D.反应停止,正、逆反应速率都等于零 |
有反应mA(g)+nB(g) 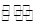 wC(g),测得在同一时间 内A每分钟减少0.15 mol·L- 1,B每分钟减少0.05 mol·L-1,C每分钟增加0.1 mol·L- 1,则下列叙述不正确的是( )
wC(g),测得在同一时间 内A每分钟减少0.15 mol·L- 1,B每分钟减少0.05 mol·L-1,C每分钟增加0.1 mol·L- 1,则下列叙述不正确的是( )
| A.m∶n∶w=3∶1∶2 |
| B.体积和温度不变时,若在前10s内A减少了x mol,则在前20s内减少小于2x mol |
| C.体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 |
| D.单位时间内反应物浓度的减少等于生成物浓度的增加 |
 2C(g)+2D(s)达到平衡,下列描述一定正确的是
2C(g)+2D(s)达到平衡,下列描述一定正确的是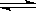 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是