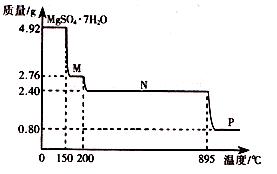
题目内容
(15分)
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为 。
②下列选项能判断该反应达到平衡状态的依据的有____ 。
A. | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
 (3)已知在常温常压下:
(3)已知在常温常压下:
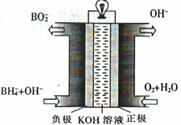
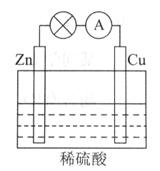
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为____
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.

电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 。
(15分)
(1)极性(2分)
(2)60%(2分) CF(2分,全对得2分,只选1个且正确的得1分,选错1个扣1分,扣完为止)
(3)(b-a-4c)/2(3分)
(4)CH3OH-6e-+8OH-=CO32-+6H2O(3分) 3.2g(3分,数值正确、未写单位的扣1分)
解析

练习册系列答案
相关题目
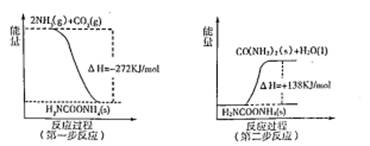
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
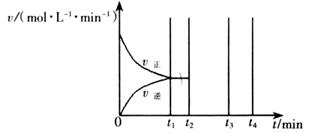
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
下列说法正确的是_______。
| A.ΔH=-92.4kJ/mol |
| B.使用催化剂会使E1的数值增大 |
| C.为了提高转化率,工业生产中反应的浓度越低越好 |
| D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB |
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为
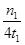 mol/(L·min)
mol/(L·min)(3) —定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的
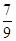 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______(4)已知H2(g)的燃烧热为285.8 kJ/mol,试写出表示NH3(g)燃烧热的热化学反应方程式_____。以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为_______经測定,该电作过程中每放出1molN2实际提供460kJ的电能,则该燃料电池的实际效率为_____(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数)
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。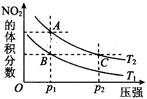
 N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
 2NH3 (g) ΔH ="c" kJ? mol-1
2NH3 (g) ΔH ="c" kJ? mol-1