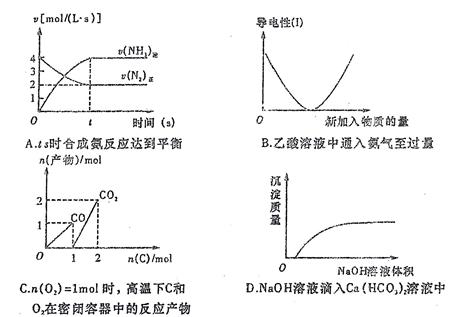
题目内容
有反应mA(g)+nB(g)  wC(g),测得在同一时间 内A每分钟减少0.15 mol·L- 1,B每分钟减少0.05 mol·L-1,C每分钟增加0.1 mol·L- 1,则下列叙述不正确的是( )
wC(g),测得在同一时间 内A每分钟减少0.15 mol·L- 1,B每分钟减少0.05 mol·L-1,C每分钟增加0.1 mol·L- 1,则下列叙述不正确的是( )
| A.m∶n∶w=3∶1∶2 |
| B.体积和温度不变时,若在前10s内A减少了x mol,则在前20s内减少小于2x mol |
| C.体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 |
| D.单位时间内反应物浓度的减少等于生成物浓度的增加 |
D
解析试题分析:A、单位时间内物质的浓度的改变量即是该反应的反应速率,而用不同物质表示同一反应的反应速率时,反应速率之比等于化学方程式中的系数之比,所以m:n:w=0.15:0.05:0.1=3:1:2,正确;B、体积和温度不变时,若在前10s内A减少了x mol,随着反应的进行,物质的浓度逐渐减小,反应速率逐渐降低,所以在前20s内减少小于2x mol,正确;C、体积和温度不变时,随反应进行压强逐渐下降,达到平衡时压强不再变化,保持恒定,正确;D、达到平衡时,对于同一物质而言,单位时间内反应物浓度的减少等于生成物浓度的增加,不同物质应满足化学方程式中的系数比,错误,答案选D。
考点:考查化学反应速率与化学方程式系数的关系,平衡的判断,反应速率的变化

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案足量Zn粉与50ml、 0.1mol/L的稀硫酸充分反应。为了减慢此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加Na2SO4溶液;②改用50ml、0.1mol/L的稀盐酸;③改用50ml、0.05mol/L的硝酸;
④加适量固体醋酸钠;⑤减压;⑥冰水浴;⑦加NaCO3溶液;⑧纯Zn改为不纯的Zn
| A.①④⑥ | B.③⑤⑥⑦⑧ | C.①②⑤⑥ | D.全部 |
在溶液中,CaCl2+CO2+H2O=CaCO3↓+2HCl在任何条件下都不能发生,原因是该反应的( )
| A.△H >0ΔS>0 | B.△H<0ΔS<0 | C.△H<0 ΔS>0 | D.△H >0ΔS<0 |
已知有反应:I2(g)+H2(g) 2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
| 选项 | X | Y |  |
| A | 温度 | 容器内混合气体的密度 | |
| B | I2的物质的量 | H2的转化率 | |
| C | H2的浓度 | 平衡常数K | |
| D | 加入Ar的物质的量 | 逆反应速率 |
下列关于化学反应限度的说法正确的是( )
| A.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率相等 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
| D.化学反应的限度不可以通过改变条件而改变 |
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是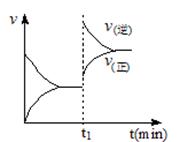
A.2SO2(g)+O2(g)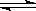 2SO3(g) △H<0 2SO3(g) △H<0 |
B.4NH3(g)+5O2(g)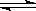 4NO(g)+6H2O(g) △H<0 4NO(g)+6H2O(g) △H<0 |
C.H2(g)+I2(g)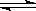 2HI(g) △H>0 2HI(g) △H>0 |
D.C(s)+H2O(g)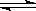 CO(g)+H2(g) △H>0 CO(g)+H2(g) △H>0 |
已知某反应aA(g)+bB(g)?==?cC(g)的各物质浓度数据如下:
| | A | B | C |
| 起始浓度(mol·L-1) | 3.0 | 1.0 | 0 |
| 2 s末浓度(mol·L-1) | 1.8 | 0.6 | 0.8 |
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
下列措施对增大化学反应速率明显有效的是
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将铝片改为铝粉,做铝与氧气反应的实验 |