题目内容
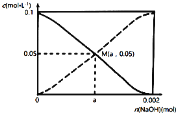
【题目】698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间的变化关系如图所示。
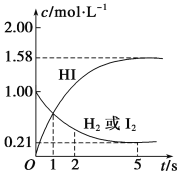
该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为:____kJ。
【答案】放出 41.87 kJ
【解析】
由热化学方程式H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,可知正反应放热;根据图像可知,氢气的起始浓度是1.00molL,起始物质的量是2mol,所以容器容积是2L,根据图像可知,氢气的浓度减少了0.79mol/L,所以消耗氢气的物质的量是0.79mol/L×2L=1.58mol,因此达到平衡反应放出的热量是1.58mol×26.5 kJ·mol-1=41.87 kJ。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某研究小组探究氨基甲酸铵(NH2COONH4)分解的化学平衡和水解反应速率。
(1)将一定量纯净的氨基甲酸铵置于固定容积为 100mL 的密闭真空溶液 A 中,在恒定温度下使其达到分解 平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g),若 25.0℃时达到平衡所用时间为8min,根据数据计算 NH3 的平均生成速率为__________。
②可以判断该分解反应已经达到化学平衡的是_____。
A. 2v(NH3)正=v(CO2)逆
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵 溶液测定水解反应速率,得到 c(NH2COO-)随时间变化趋势如图所示。根据图中信息,如何说明水解反应速率随温度升高而增大:_____。

(3)合成氨工业对国民经济和社会发展具有重要意义。工业合成氨常用的催化剂是_____,氨分子的电子式是_____。
(4)如图是一定的温度和压强下时 N2 和 H2 反应生成 1molNH3 过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:__________________________。(热量 Q 的数值使用含字母 a、b 的代数式表示)

(5)在催化剂存在下,NH3 可用来消除 NO 的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是_______________。