��Ŀ����
����Ŀ��ij�о�С��̽����������泥�NH2COONH4���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ�
��1����һ���������İ�����������ڹ̶��ݻ�Ϊ 100mL ���ܱ������Һ A �У��ں㶨�¶���ʹ��ﵽ�ֽ� ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ�����������ʵ�����mol�� | 0.34 | 0.48 | 0.68 | 0.94 |
����������立ֽ�Ļ�ѧ����ʽΪ NH2COONH4(s) 2NH3(g)+CO2(g)���� 25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ��� NH3 ��ƽ����������Ϊ__________��
�������жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����_____��
A. 2v(NH3)��=v(CO2)��
B.�ܱ���������ѹǿ����
C. �ܱ������л��������ܶȲ���
D. �ܱ������а����������������
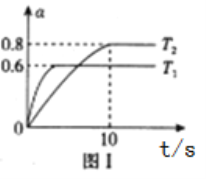
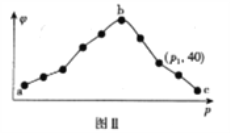
��2����֪��NH2COONH4+2H2O NH4HCO3+NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ�������� ��Һ�ⶨˮ�ⷴӦ���ʣ��õ� c(NH2COO-)��ʱ��仯������ͼ��ʾ������ͼ����Ϣ�����˵��ˮ�ⷴӦ�������¶����߶�����_____��

��3���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ���塣��ҵ�ϳɰ����õĴ�����_____�������ӵĵ���ʽ��_____��
��4����ͼ��һ�����¶Ⱥ�ѹǿ��ʱ N2 �� H2 ��Ӧ���� 1molNH3 �����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ��Ӧ����ʽ��__________________________�������� Q ����ֵʹ�ú���ĸ a��b �Ĵ���ʽ��ʾ��

��5���ڴ��������£�NH3 ���������� NO ����Ⱦ���������ֶԻ����������ʡ�д����Ӧ�Ļ�ѧ����ʽ��_____________________���÷�Ӧ�����������뻹ԭ��������ʵ���֮����_______________��
���𰸡�0.4mol/(L��min��BC25�淴Ӧ����ʼŨ�Ƚ�С���� 0��6min ��ƽ����Ӧ���ʣ����ߵ�б�ʣ��Ա� 15�������ý![]() N2(g)+3H2(g)��2NH3(g)
N2(g)+3H2(g)��2NH3(g) ![]() H=+(b-a)kJ��mol��14NH3+6NO
H=+(b-a)kJ��mol��14NH3+6NO ![]() 5N2+6H2O2:3
5N2+6H2O2:3
��������
��1������ѧ��Ӧ����V=��c/��t
�����ݻ�ѧƽ��ı�־���жϣ����淴Ӧ������ͬ�������Ũ�ȱ��ֲ��估�������ĸ��ֹ�ϵ����ƽ���־��
��2����ͼ�����ݿ��Եó����ò�ͬ��ʼŨ�ȣ���ͬ�¶��µ�ƽ�����ʵĴ�С��˵����
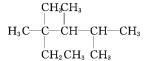
��3����ҵ�ϳɰ����õĴ���������ý����������һ����ԭ�Ӻ�������ԭ���γ���������ۼ���
��4����ͼ���N2��H2��Ӧ����1molNH3�ķ�Ӧ�ȣ��ٸ����Ȼ�ѧ��Ӧ����ʽ����д���
��5���ڴ��������£�NH3 ���������� NO ����Ⱦ�����ɵ�����ˮ��д����Ӧ�Ļ�ѧ����ʽ���÷�Ӧ�����������뻹ԭ��������ʵ���֮�ȵ��ڻ�ԭ����������֮�ȡ�
��1������ѧ��Ӧ����V=��c/��t=![]() ==0.4mol/(L��min����
==0.4mol/(L��min����
��A�������Ȳ����ڷ���ʽ������֮������A����ȷ��
B���÷�Ӧ�������������ķ�Ӧ���ʵ�������ѹǿ����ʱ���Ѵﵽƽ�⣬��B��ȷ��
C���÷�Ӧ�������������ķ�Ӧ���ʵ��ܱ������л��������ܶȲ��䣬�Ѵﵽƽ�⣬��C��ȷ��
D����Ӧ�NH2COONH4���ǹ������ʣ������ܱ�������NH3���������ʼ�ղ��䣬Ϊ2/3����D����ȷ��
��ѡ��BC��
��2����25�淴Ӧ����ʼŨ�Ƚ�С����0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��Ա�15���
��3����ҵ�ϳɰ����õĴ���������ý����������һ����ԭ�Ӻ�������ԭ���γ���������ۼ��������ӵĵ���ʽ��![]() ��
��
��4����ͼ��֪��N2��H2��Ӧ����1molNH3�ų�������Ϊ��b-a��kJ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪN2(g)+3H2(g)��2NH3(g) ![]() H=+(b-a)kJ��mol��1��
H=+(b-a)kJ��mol��1��
��5���ڴ��������£�NH3 ���������� NO ����Ⱦ�����ɵ�����ˮ��д����Ӧ�Ļ�ѧ����ʽ4NH3+6NO ![]() 5N2+6H2O���÷�Ӧ�����������뻹ԭ��������ʵ���֮�ȵ��ڻ�ԭ����������֮�ȣ�4��6=2��3��
5N2+6H2O���÷�Ӧ�����������뻹ԭ��������ʵ���֮�ȵ��ڻ�ԭ����������֮�ȣ�4��6=2��3��

����Ŀ�����з�Ӧ�У��������ͼ�������ǣ��� ����
����
A | B | C | D |
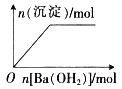
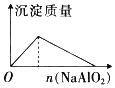
NaHSO4��Һ����μ���Ba(OH)2 ��Һ | �������е���NaAlO2��Һ | ��ͭ�ۼ��뵽һ����Ũ������ | �����ۼ��뵽һ�����Ȼ�����Һ�� |
|
|
|
|
A. AB. BC. CD. D