题目内容
【题目】常温下,向20.00mL0.1000mol·L-1CH3COOH溶液中慢慢加入NaOH固体。CH3COOH与CH3COO-的浓度变化趋势如图所示(不考虑溶液体积和温度的变化)。n(NaOH)=0.001mol时,溶液呈酸性。下列说法正确的是
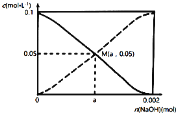
A.当n(NaOH)=0.002mol时,c(CH3COO-)>c(Na+)>c(CH3COOH)
B.在M点时,n(OH-)-n(H+)=a-0.05
C.a<0.001mol
D.当n(NaOH)=0.001mol时,c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
【答案】C
【解析】
20.00mL0.1000mol/LCH3COOH溶液中含有CH3COOH的物质的量是0.002mol,加入氢氧化钠0.001mol时,溶液中含有的CH3COOH和CH3COONa均为0.001mol,溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度。
A.加入NaOH0.002mol时,恰好完全反应生成醋酸钠,由于醋酸根离子发生水解作用,溶液中c(Na+)>c(CH3COO-)>c(CH3COOH),A错误;
B.根据分析,当加入NaOH0.001mol溶液显酸性,溶液中c(CH3COOH)<c(CH3COO-),M点时c(CH3COOH)=c(CH3COO-),说明加入氢氧化钠少于0.001mol,根据电荷守恒,n(OH-)+n (CH3COO-)= c(Na+)+n(H+),可得n(OH-)- n(H+)= c(Na+)-n (CH3COO-)=(a-0.001)mol,B错误;
C.结合B分析可知,要想使溶液中c(CH3COOH)=c(CH3COO-),说明加入氢氧化钠一定要少于0.001mol,C正确;
D.根据电荷守恒,n(OH-)+n(CH3COO-)=c(Na+)+n(H+)①,根据物料守恒得2c(Na+)=c (CH3COO-)+c(CH3COOH)②,结合①②得2c(H+)+c(CH3COOH)= n(CH3COO-)+2c(OH-),D错误;
故合理选项是C。