题目内容
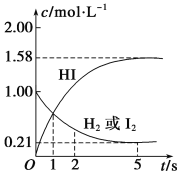
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )

A. 原混合酸中NO3-物质的量为0.1 mol
B. OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 molL-1
【答案】A
【解析】
第一份混合酸中加入铜粉发生反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,9.6gCu的物质的量=![]() =0.15mol,根据计量数可得同时消耗0.4mol H+和0.1mol NO3-;
=0.15mol,根据计量数可得同时消耗0.4mol H+和0.1mol NO3-;
第二份混合酸中有关粒子的氧化性强弱顺序为:HNO3>Fe3+>H+,因此铁粉加到第二份混合酸中将依次发生三个反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,分别对应图像上OA段,AB段,BC段。由此分析。
A.根据有关粒子的氧化性强弱顺序:HNO3>Fe3+>H+,铁粉加到100mL混合酸中将依次发生三个反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,即对应图像上OA段,AB段,BC段的反应。OA段消耗铁粉的物质的量=![]() =0.1mol,根据反应计量关系可知同时消耗0.4molH+,0.1molNO3-,由于BC段有H2放出,说明OA段溶液中H+过量,因此0.1mol NO3-耗尽后没有剩余,所以原200mL混合酸中含有的NO3-的物质的量=0.1mol×2=0.2mol,A项错误;
=0.1mol,根据反应计量关系可知同时消耗0.4molH+,0.1molNO3-,由于BC段有H2放出,说明OA段溶液中H+过量,因此0.1mol NO3-耗尽后没有剩余,所以原200mL混合酸中含有的NO3-的物质的量=0.1mol×2=0.2mol,A项错误;
B. 根据有关粒子的氧化性强弱顺序:HNO3>Fe3+>H+,铁粉加到混合酸中将依次发生三个反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,即对应图像上OA段,AB段,BC段的反应,所以OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气,B项正确;
C.根据上面的分析可知图像OA段、AB段、BC段对应的反应分别是:Fe+4H++NO3-=Fe3++NO↑+2H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,分析这三个离子反应可知混合酸和铁粉的转化:铁元素最终转化为Fe2+,氢元素最终转化为H2O或H2,NO3-最终转化为NO,SO42-没有参与反应,所以第二份溶液中最终溶质为FeSO4,C项正确;
D.根据上面的分析可知图像OA段、AB段、BC段对应的反应分别是:Fe+4H++NO3-=Fe3++NO↑+2H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,OA段消耗铁粉的物质的量=![]() =0.1mol,根据反应计量数可得OA段消耗0.4molH+,0.1molNO3-;BC段消耗铁粉物质的量=
=0.1mol,根据反应计量数可得OA段消耗0.4molH+,0.1molNO3-;BC段消耗铁粉物质的量=![]() =0.1mol,根据反应计量数可得BC段消耗H+0.2mol,由此可知每份混合酸中含0.4mol+0.2mol =0.6mol H+,因含0.1molHNO3,则含H2SO4物质的量=
=0.1mol,根据反应计量数可得BC段消耗H+0.2mol,由此可知每份混合酸中含0.4mol+0.2mol =0.6mol H+,因含0.1molHNO3,则含H2SO4物质的量=![]() =0.25mol,硫酸的浓度=
=0.25mol,硫酸的浓度=![]() =2.5mol/L,D项正确;答案选A。
=2.5mol/L,D项正确;答案选A。

【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。

①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
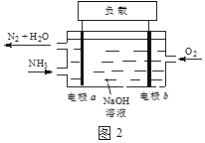
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。