题目内容
4.某化学课外兴趣小组为探究铜与浓硫酸的反应,用图1所示的装置进行实验: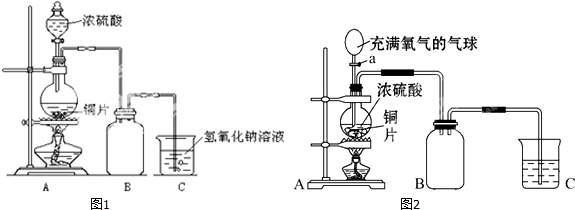
请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL 18mol•L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,实验中若有m g铜参加了反应,则有$\frac{m}{64}$mol硫酸被还原.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是D(填写字母编号).
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
(3)为了测定剩余硫酸的物质的量浓度,该小组设计了以下三种实验方案.
说明方案二不可行的原因,计算方案三中测定的剩余硫酸的物质的量浓度:
①方案一:将装置A产生的气体缓缓通过已称量的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫的质量.请判断方案一是否可行不可行;
②方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即二氧化硫转化为硫酸钡沉淀的质量.说明方案二不可行的原因沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的;
③方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).计算:剩余硫酸的物质的量浓度为(假设反应后溶液的体积仍为12mL)$\frac{V}{22.4×0.012}$mol/L.
(4)如图2所示,某同学改进上述实验装置,先关闭活塞a,加热至烧瓶中不再有气泡产生时,再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少直至完全消失.
写出上述过程打开活塞a后A装置中所发生的化学反应方程式2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O(或2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4═CuSO4+2H2O).
分析 (1)铜和浓硫酸加热一生成二氧化硫气体,二氧化硫比空气重,用向上排气法收集,进气的导气管长进短处;
(2)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;依据反应方程式计算被还原的硫酸的物质的量;
②通过证明反应后的溶液中存在氢离子,可以证明硫酸有剩余;
(3)方案一,碱石灰增重为二氧化硫和水蒸气的质量分析;
方案二,硫酸钡沉淀是二氧化硫被氧化为硫酸生成的硫酸钡沉淀和硫酸酸化高锰酸钾溶液,气酸化作用的硫酸生成的硫酸钡沉淀;
方案三,依据生成氢气计算硫酸物质的量结合浓度概念计算剩余硫酸浓度;
(4)依据装置图和实验步骤分析,装置A中在关闭a后加热烧瓶反应,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失是铜和氧气反应生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水.
解答 解:(1)铜和浓硫酸加热一生成二氧化硫气体,二氧化硫比空气重,用向上排气法收集,进气的导气管长进短处,图中补进气管伸入近集气瓶底,装置图为: ,故答案为:
,故答案为: ;
;
(2)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,根据化学方程式可知若有m g铜物质的量为$\frac{m}{64}$mol参加了反应,被还原硫酸物质的量为$\frac{m}{64}$mol,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;$\frac{m}{64}$;
②能证明反应停止后烧瓶中有硫酸剩余,只要证明氢离子的存在即可,当不能依据溶液中存在硫酸根离子而证明浓硫酸有剩余,
A.硫酸钠溶液不与氢离子反应,无法证明硫酸有剩余,故A错误;
B.氯化钡溶液能证明硫酸根离子存在,但不能证明氢离子存在,故B错误;
C.银粉和稀硫酸不反应,则不能证明氢离子的存在,故C错误;
D.碳酸钠溶液和氢离子反应生成二氧化碳气体,有气体生成可以证明反应后的溶液中存在氢离子,从而证明明溶液中存在稀硫酸,故D正确;
故答案为:D;
(3)方案一:铜和浓硫酸反应生成的二氧化硫气体中含有水蒸气,碱石灰吸收的质量为二氧化硫和水蒸气,故该方案不可行,
故答案为:不可行;
方案二:生成的沉淀是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的沉淀和二氧化硫被氧化为硫酸生成的硫酸钡沉淀,不全是二氧化硫转化为硫酸生成的沉淀,
故答案为:沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的;
方案三:依据化学方程式Zn+H2SO4=ZnSO4+H2↑,生成氢气物质的量=$\frac{V}{22.4}$mol,所以剩余稀硫酸浓度为:$\frac{V}{22.4×0.012}$mol/L,
故答案为:$\frac{V}{22.4×0.012}$mol/L;
(4)装置图和实验步骤可知,先关闭活塞a,加热至烧杯中不再有气泡产生时,停止反应,此时烧瓶中铜片仍有剩余,此时反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失,发生的反应为:2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;或2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4═CuSO4+2H2O,
故答案为:2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O(或2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4═CuSO4+2H2O).
点评 本题通过浓硫酸的性质考查了性质实验方案的设计与评价,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的想、理解能力,注意熟练掌握浓硫酸与铜的反应原理,明确性质实验方案的设计及评价原则.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案①光气(COCl2) ②六氟化硫 ③HCHO ④三氟化硼 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧二氟化氙 ⑨N2 ⑩CH4.
| A. | ⑥⑦⑨ | B. | ①⑤⑨ | C. | ①④⑤⑦ | D. | ①④⑤⑨ |
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 7种 |
| A. | NO是一种红棕色的气体 | |
| B. | 常温常压下NO不能与空气中的氧气直接化合 | |
| C. | 含等质量的氧元素的NO和CO的物质的量相等 | |
| D. | NO易溶于水,不能用排水法收集 |
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法判断 |
 室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )
室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )| A. | I曲线表示的是滴定盐酸的曲线 | |
| B. | x=20 | |
| C. | 滴定过程中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值逐渐减小 | |
| D. | 当I曲线和II曲线pH均为7时,一溶液中的c(Cl-)等于另一溶液中的c(CH3COO-) |
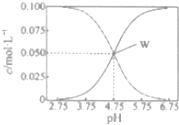 25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | 25℃时,醋酸的电离常数Ka=1×10-4.75 | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |