题目内容
12.下列关于NO的叙述正确的是( )| A. | NO是一种红棕色的气体 | |
| B. | 常温常压下NO不能与空气中的氧气直接化合 | |
| C. | 含等质量的氧元素的NO和CO的物质的量相等 | |
| D. | NO易溶于水,不能用排水法收集 |
分析 A、NO为无色气体,二氧化氮为红棕色气体;
B、NO易与氧气化合生成二氧化氮;
C、由NO和CO可知,物质的量相同时含有等质量的氧元素;
D、NO不溶于水,可以用排水法收集
解答 解:A、NO为无色气体,二氧化氮为红棕色气体,二者不可混淆,故A错误;
B、常温常压下,一氧化氮能与空气中的氧气直接化合生成红棕色的二氧化氮,故B错误;
C、含等质量氧元素时,氧原子的物质的量相同,则一氧化氮与一氧化碳的物质的量相同,故C正确;
D、因NO不溶于水,可以用排水法收集,故D错误;故选C.
点评 本题主要考查NO的性质,比较基础,熟悉NO气体的物理性质和化学性质、注意与二氧化氮的区别是解答本题的关键.

练习册系列答案
相关题目
2.烃是( )
| A. | 含有碳、氢元素的有机物 | B. | 含有碳元素的化合物 | ||
| C. | 完全燃烧只生成CO2和H2O的有机物 | D. | 仅由碳、氢两种元素组成的有机物 |
3.电子构型为[Ar]3d54s2的元素是( )
| A. | ds区元素 | B. | 过渡元素 | C. | 主族元素 | D. | s区元素 |
20.下列反应的生成物为纯净物的是( )
| A. | CH4和Cl2光照发生取代反应 | |
| B. | 1,3-丁二烯与等物质的量的溴发生反应 | |
| C. | 乙烯和氯化氢加成 | |
| D. | 乙醇汽油 |
9.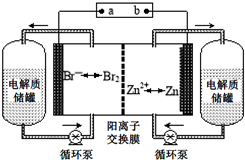 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
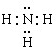 ,B的结构式为
,B的结构式为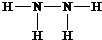 .
.