题目内容
14.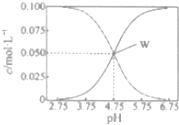 25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | 25℃时,醋酸的电离常数Ka=1×10-4.75 | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
分析 根据图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-),
A.根据电离平衡常数公式解答;
B.结合溶液的电荷守恒、物料守恒判断;
C.根据图象结合溶液pH分析;
D.根据电荷守恒、物料守恒判断.
解答 解:A.W点c(CH3COOH)=c(CH3COO-),平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).C({H}^{+})}{C(C{H}_{3}COOH)}$=10-4.75mol•L-1,故A正确;
B.由图可知,W点所表示的溶液中c(CH3COOH)=c(CH3COO-)=0.05mol/L,溶液中电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)+c(H+)=c(CH3COOH)+c(OH-),故B正确;
C.根据图象知,pH=5.5溶液中:c(CH3COOH)<c(CH3COO-),故C错误;
D.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(OH-)-c(OH-)+c(CH3COOH)=0.1mol/L,故D正确.
故选C.
点评 本题考查了离子浓度大小比较,侧重于学生的分析能力的考查,溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,再结合守恒思想分析解答,题目难度中等.

练习册系列答案
相关题目
5.下列说法不正确的是( )
| A. | 合成氨反应在低温下能够自发进行,是因为反应物键能之和大于生成物键能之和 | |
| B. | 元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属元素 | |
| C. | 人们利用元素周期律在过渡元素中寻找各种性能优良的催化剂,以降低化学反应的活化能,从而起到很好的节能效果 | |
| D. | 超高分辨率荧光显微镜能够观察到纳米尺度的物质,用它可以获得蛋白质溶液中的分子图象 |
9.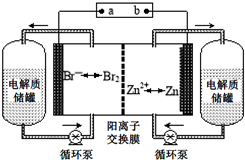 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
19.W、X、Y、Z均是短周期元素,W元素原子的最外层电子数与次外层电子数之差的绝对值等于其电子层数,X元素的原子比W元素的原子多2个电子;Y+和Z-离子具有与氖原子相同的电子层结构.下列说法错误的是( )
| A. | 上述元素中,Y的原子半径最大 | |
| B. | 上述元素中,W的气态氢化物最稳定 | |
| C. | 元素W和X可形成含有极性键的极性分子WX3 | |
| D. | 工业上可用电解熔融的Y、Z的化合物的方法冶炼Y、Z的单质 |
6.25℃时,将Na2O2逐渐加入1L含有HCl、AlCl3、MgCl2的混合溶液中,产生沉淀和气体的量与加入Na2O2的量的关系如图所示(假设整个过程中溶液条件变化忽略不计).下列说法错误的是( )
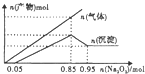

| A. | 混合溶液中m(Al3+)为5.4g | B. | 混合溶液中c(Mg2+)为0.5mol/L | ||
| C. | 混合溶液的pH=2 | D. | 混合溶液中c(Cl-)为1.7mol/L |
3.下列说法正确的是( )
| A. | 正丁烷和异丁烷互为同分异构体 | |
| B. | 乙醇和乙酸都能与氢氧化钠溶液反应 | |
| C. | 淀粉和蛋白质的水解产物都是氨基酸 | |
| D. | 葡萄糖和蔗糖都能发生水解反应 |
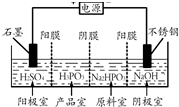 亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.
亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.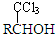 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾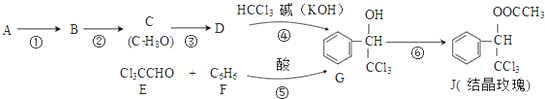
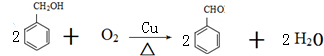 .
.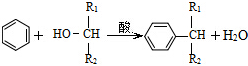 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.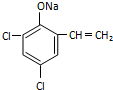 或
或 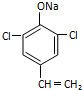 (只写一种).
(只写一种).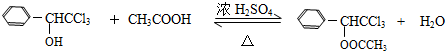 .
.