题目内容
13.有100mL混合气体,其中可能有NH3、HCl、NO和CO2等气体,把混合气体通过浓硫酸,气体体积缩小了30mL,再经过Na2O2固体后,气体体积又减少了30mL,最后经过水洗后,剩余气体体积为20mL(同温、同压下测定),试回答:(1)该混合气体是由哪些气体混合而成,各占多少毫升?
(2)最后剩余20mL是什么气体?
分析 混合气体通过足量浓硫酸气体体积减少,能与浓硫酸反应的气体只有NH3气,NH3和HCl不能共存,所以混合气体中不含HCl,且NH3体积为30mL,剩余气体体积为70mL;若剩余气体只有NO,则通过Na2O2固体气体体积不变,若完全为二氧化碳,根据反应2NaCO2+2CO2=2Na2CO3+O2可知,70mL二氧化碳完全反应生成35mL气体,气体体积减少了35mL,所以剩余的70mL为NO和CO2;发生反应为:2NaCO2+2CO2=2Na2CO3+O2、2NO+O2=2NO2,设二氧化碳、NO的体积分别为x、y,
2NaCO2+2CO2=2Na2CO3+O2△V,
2 1 1
x 0.5x
2NO+O2=2NO2 △V
2 1 2 1
y 0.5y,
再经过Na2O2固体后,气体体积又减少了30mL,则:0.5x+0.5y=30mL,即:x+y=60mL<70mL,说明二氧化碳不足,NO过量,反应后得到的气体为NO2、NO,其总气体体积为:70mL-30mL=40mL,
最后经过水洗后,剩余的20mL为NO,发生反应为:3NO2+H2O=2HNO3+NO,设40mL混合气体中NO、NO2的体积分别为x、y,根据题中数据列式计算出x、y,再根据反应方程式计算出原混合气体中含有的二氧化碳、NO气体体积.
解答 解:(1)混合气体通过足量浓硫酸气体体积减少,能与浓硫酸反应的气体只有NH3气,NH3和HCl不能共存,所以混合气体中不含HCl,且NH3体积为30mL,剩余气体体积为70mL;若剩余气体只有NO,则通过Na2O2固体气体体积不变,若完全为二氧化碳,根据反应2NaCO2+2CO2=2Na2CO3+O2可知,70mL二氧化碳完全反应生成35mL气体,气体体积减少了35mL,所以剩余的70mL为NO和CO2;
发生反应为:2NaCO2+2CO2=2Na2CO3+O2、2NO+O2=2NO2,设二氧化碳、NO的体积分别为x、y,
2NaCO2+2CO2=2Na2CO3+O2 △V,
2 1 1
x 0.5x
2NO+O2=2NO2 △V
2 1 2 1
y 0.5y,
再经过Na2O2固体后,气体体积又减少了30mL,则:0.5x+0.5y=30mL,即:x+y=60mL<70mL,说明二氧化碳不足,NO过量,反应后得到的气体为NO2、NO,其总气体体积为:70mL-30mL=40mL,
最后经过水洗后,剩余的20mL为NO,发生反应为:3NO2+H2O=2HNO3+NO,
设40mL混合气体中NO、NO2的体积分别为x、y,
则:x+y=40mL、x+$\frac{1}{3}$y=20mL,
解得:x=10mL、y=30mL,
根据反应2NO+O2=2NO2可知,二氧化碳与过氧化钠反应生成氧气的体积为:30mL×$\frac{1}{2}$=15mL,
根据反应2NaCO2+2CO2=2Na2CO3+O2可知原混合气体中CO2的体积为:15mL×2=30mL;
所以原混合气体中NO的体积为:70mL-30mL=40mL,
答:该混合气体中含有30mL氨气、40mLNO和30mL二氧化碳;
(2)根据(1)的分析可知,剩余的20mL气体为NO,答:最后剩余20mL是NO气体.
点评 本题考查了混合物反应的计算,题目难度较大,明确常见气体的性质及发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| B. | 油脂是高分子化台物,水解可生成甘油和高级脂肪酸 | |
| C. | 煤中含有的煤焦油,可由煤干馏获得 | |
| D. | 聚乙烯塑料的老化是因为发生了加成反应 |
| A. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 |
| A. | Na和O2 | B. | Fe和稀HNO3 | C. | Cu和FeCl3溶液 | D. | Na2CO3和稀HCl |
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验: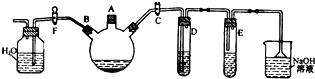

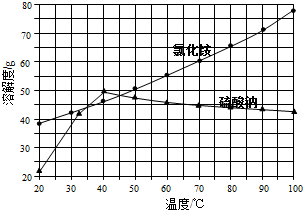
 在实验室里制取乙烯的反应为:
在实验室里制取乙烯的反应为: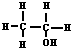 $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O
$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O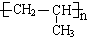 .
.