题目内容
18.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如图:
氯化铵和硫酸钠的溶解度随温度变化如图所示.已知NH4Cl固体受热时可完全分解为气体.回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl11.7g.
(2)实验室进行蒸发浓缩用到的主要仪器有蒸发皿、烧杯、玻璃棒、酒精灯等.
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为35℃.
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是取少量所得样品于大试管中,加强热,若无固体剩余,证明产品纯净.
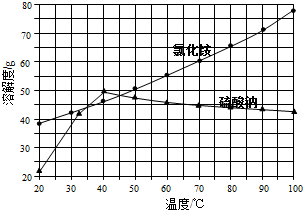
分析 将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,
(1)根据Cl元素守恒计算NaCl的质量;
(2)蒸发液体用蒸发皿;
(3)从溶解度曲线判断硫酸钠和氯化铵的溶解度变化特点分析,在35-45℃时,氯化铵的溶解度小于硫酸钠的溶解度;
(4)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净.
解答 解:将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,
(1)10.7g NH4Cl的物质的量为$\frac{10.7g}{53.5g/mol}$=0.2mol,根据Cl元素守恒,需要NaCl的物质的量也为0.2mol,质量为0.2mol×58.5g/mol=11.7g,
故答案为:11.7;
(2)实验室进行蒸发浓缩用到的主要仪器有 蒸发皿、烧杯、玻璃棒、酒精灯等,
故答案为:蒸发皿;
(3)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35~45℃时,氯化铵的溶解度小于硫酸钠的溶解度,
故答案为:35℃;
(4)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净,操作是:取少量所得样品于大试管中,加强热,若无固体剩余,证明产品纯净,
故答案为:取少量所得样品于大试管中,加强热,若无固体剩余,证明产品纯净.
点评 本题难度不是很大,主要考查了根据固体物质的溶解度曲线解决相关的问题,培养学生分析问题、解决问题的能力.

| A. | NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA | |
| B. | 1mol苯分子中含有3NA个碳碳单键 | |
| C. | 24g NaH中阴离子所含电子总数为NA | |
| D. | 在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:(1)甲同学认为该反应为放热反应,他的理由为:反应物的总能大于生成物的总能量
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如表所示.从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)=0.05mol/(L.min);
反应达到平衡状态,此时H2的转化率为75%.
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
d.H2的消耗速率与CH3OH的消耗速率之比为3:1.
| A. | V(碱)=10V(酸) | B. | V(酸)=10V(碱) | C. | V(酸)=2V(碱) | D. | V(酸)=V(碱) |
| A. | 将点燃的镁条伸入充满CO2气体的集气瓶中:2Mg+CO2═点燃 2MgO+C | |
| B. | 大理石溶于醋酸:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| D. | 向淀粉KI溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2═2I2+2H2O |


 .
.