题目内容
20.能正确表示下列反应的离子方程式是( )| A. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═CO2↑+2H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
分析 A.碳酸氢钠过量,离子方程式按照氢氧化钙的化学式组成书写,碳酸根离子有剩余;
B.溶液为中性,则硫酸氢钠与氢氧化钡按照物质的量2:1反应;
C.碳酸氢根离子不能拆开,需要保留整体形式;
D.铁与稀硫酸反应生成硫酸亚铁,不是生成铁离子.
解答 解:A.向Ca(OH)2溶液中加入过量的NaHCO3溶液,反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O,故A正确;
B.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7,则氢离子与氢氧根离子的物质的量相等,正确的离子方程式为:2H++2SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B错误;
C.NaHCO3溶液与稀H2SO4反应生成硫酸钠、二氧化碳气体和水,正确的离子方程式为:HCO3-+H+═CO2↑+2H2O,故C错误;
D.铁与稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
相关题目
10.设阿伏加德罗常数的值为NA,下列说法正确的是( )
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g | |
| C. | 铝跟氢氧化钠溶液反应,生成3.36 L H2,转移的电子数为0.3 NA | |
| D. | 50 mL 8 mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA |
8.下列说法正确的是( )
| A. | 据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=2.0×10-12,可推知AgCl溶解度比Ag2CrO4的溶解度大 | |
| B. | 0.1mol/L的ZnCl2溶液中通入足量硫化氢最终得不到ZnS沉淀是因为c(Zn2+)•c(S2-)<Ksp(ZnS) | |
| C. | 向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的大 | |
| D. | AgCl在10 mL 0.1 mol/L的KCl中溶解的质量比在10 mL 0.05 mol/L的AgNO3溶液中少 |
15.下列关于氯化铵溶液的说法正确的是( )
| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
12.下列化学用语正确的是( )
| A. | 甲烷的球棍模型: | B. | 硝基苯的结构简式: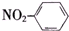 | ||
| C. | 苯的最简式:C6H6 | D. | 1-丁醇的键线式: |
9.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 甲烷与氯气发生取代反应 | |
| B. | 丙烯与水在催化剂的作用下发生加成反应 | |
| C. | 异戊二烯[CH2═C(CH3)-CH═CH2]与等物质的量的Br2发生加成反应 | |
| D. | 2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热 |
