题目内容
7.主族元素X、Y、Z的常见离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法不正确的是( )| A. | b一定小于c | B. | 单质的氧化性Z>Y | ||
| C. | Y2-的还原性大于Z- | D. | X、Y可处于同周期或X在Y的下周期 |
分析 A.若bY2-、cZ-离子核外电子层结构相同,则Y、Z同周期,原子序数b<c,若bY2-、cZ-离子核外电子层结构不相同,则Y离子电子层较多;
B.Y、Z同周期时,随原子序数增大非金属性增强,单质氧化性增强;
C.非金属性越强,阴离子还原性越弱;
D.若X+、Y2-离子电子层结构相同,则X处于Y的下一周期,若X+、Y2-离子电子层结构不相同,则X与Y可能同周期,也可能Y原子电子层较多.
解答 解:A.若bY2-、cZ-离子核外电子层结构相同,则Y、Z同周期,原子序数b<c,若bY2-、cZ-离子核外电子层结构不相同,则Y离子电子层较多,原子序数c<b,故A错误;
B.若bY2-、cZ-离子核外电子层结构相同,Y、Z同周期,原子序数b<c,随原子序数增大非金属性增强,单质氧化性增强,故B正确;
C.Y、Z同周期或Y原子的电子层较多,非金属性均为Y<Z,非金属性越强,阴离子还原性越弱,故C正确;
D.若X+、Y2-离子电子层结构相同,则X处于Y的下一周期,若X+、Y2-离子电子层结构不相同,则X与Y可能同周期,也可能Y原子电子层较多,故D正确,
故选A.
点评 本题考查元素位置结构性质的相互关系应用,题目难度较大,注意题目没有告诉三种离子核外电子排布是否相同这一点.

练习册系列答案
相关题目
17. 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:
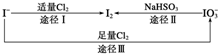
(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
根据表中数据,可得出的两条结论是①条件相同时,I3-离子的物质的量分数组成始终占绝对优势(或I3-含量高,I42-含量低)、②?随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加.;
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
15.下列关于氯化铵溶液的说法正确的是( )
| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
12.下列化学用语正确的是( )
| A. | 甲烷的球棍模型: | B. | 硝基苯的结构简式: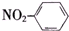 | ||
| C. | 苯的最简式:C6H6 | D. | 1-丁醇的键线式: |
19.判断下列有关化学基本概念的依据正确的是( )
| A. | 共价化合物:是否含有共价键 | |
| B. | 氧化还原反应:元素化合价是否变化 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
16.下列每组物质发生所述变化克服的作用属于同种类型的是( )
| A. | 氯化铝和干冰升华 | B. | 钠和硫熔化 | ||
| C. | 食盐和氯化氢溶解于水 | D. | 二氧化硅和二氧化硫熔化 |
17.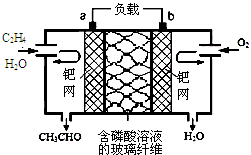 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.| A. | 该电池可以实现化学能和电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 正极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 每有1mol 乙烯反应,则迁移2 mol H+ |

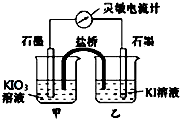 将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.
将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.