题目内容
下列有关叙述正确的是( )
A.在一定条件下,反应CO(g)+2H2(g)  CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 |
| B.常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+ c(CH3COOH)=0.01mol/L |
| C.pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① |
| D.已知某温度下:Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)= 1×10-12,,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/LK2CrO4溶液,则先产生Ag2CrO4沉淀 |
A
解析试题分析:A、充入氢气,增大容器的体积,则CO和甲醇的浓度同等倍数的减少,则此时的浓度商与平衡常数相等,所以平衡不移动,CO的转化率不变,正确;B、醋酸是弱酸,当醋酸与氢氧化钠恰好完全反应时生成醋酸钠,而醋酸的物质的量未知,所以c(CH3COO-)+ c(CH3COOH)未知,错误;C、根据盐水解的规律:越弱越水解,三种盐浓度相对时的水解程度的大小顺序是③>②>①,溶液的碱性的顺序也是③>②>①,现在三种溶液的pH相同,所以溶液的浓度的大小关系是③<②<①,则c(Na+)的大小顺序是③<②<①,错误;D、当Cl-与CrO42-的浓度相同时,生成AgCl沉淀时所需Ag+的浓度是Ksp(AgCl)/0.001=1.56×10-7mol/L,生成Ag2CrO4沉淀时所需Ag+的浓度是 =1×10-4.5mol/L>1.56×10-7mol/L,所以AgCl先沉淀,错误,答案选A。
=1×10-4.5mol/L>1.56×10-7mol/L,所以AgCl先沉淀,错误,答案选A。
考点:考查化学平衡的判断,盐的水解规律的应用,溶液浓度的比较,溶度积的应用

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案下面关于化学反应的限度的叙述中,正确的是
| A.化学反应的限度都相同 |
| B.可以通过改变温度控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应的限度 |
| D.当一个化学反应在一定条件下达到限度时,反应即停止 |
已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
| A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化 |
(原创)下图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况。达到平衡后,改变压强,平衡不移动。下列说法中正确的是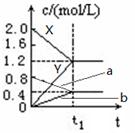
| A.Z物质的变化情况为曲线b |
B.该反应的化学方程式为:2X(g)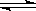 3Y(g) + Z(g) 3Y(g) + Z(g) |
| C.0→t1,X的物质的量浓度变化量为1.2mol/L |
| D.若t1= 1min,则v(Y )=" 0.02" mol·L-1·s-1 |
在2L密闭容器中进行的反应2SO2(g)+O2(g) 2SO3(g),在10秒内反应物SO2的物质的量由1mol降到0.6mol,则反应速率ν(O2)为( )
2SO3(g),在10秒内反应物SO2的物质的量由1mol降到0.6mol,则反应速率ν(O2)为( )
| A.0.02mol/(L·s) | B.0.04mol/((L·s) | C.0.01mol/((L·s) | D.0.2mol/((L·s) |
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1 s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)
| A.t1>t2 | B.t1<t2 | C.t1=t2 | D.不能肯定 |
(5分)在某容积可变的密闭容器中,有下列的可逆反应:A(g) + B(g) 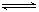 xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线。若试判断对图2的说法中正确的是
xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线。若试判断对图2的说法中正确的是 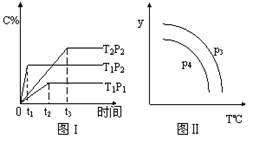
| A.P3>P4,y轴表示C的体积分数 |
| B.P3<P4,y轴表示B的质量分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如下图。下列叙述中正确的是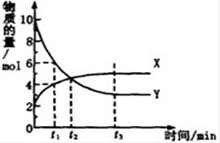
| A.反应的化学方程式为5Y?X |
| B.t1时,Y的浓度是X浓度的1.5倍 |
| C.t2时,正、逆反应速率相等 |
| D.t3时,逆反应速率大于正反应速率 |