题目内容
在2L密闭容器中进行的反应2SO2(g)+O2(g) 2SO3(g),在10秒内反应物SO2的物质的量由1mol降到0.6mol,则反应速率ν(O2)为( )
2SO3(g),在10秒内反应物SO2的物质的量由1mol降到0.6mol,则反应速率ν(O2)为( )
| A.0.02mol/(L·s) | B.0.04mol/((L·s) | C.0.01mol/((L·s) | D.0.2mol/((L·s) |
C
解析试题分析:10秒内反应物SO2的物质的量由1mol降到0.6mol,则氧气得物质的量减少(1-0.6)/2=0.2mol,所以氧气得浓度减少0.2mol/2L=0.1mol/L,所以ν(O2)=0.1mol/L/10s=0.01mol/(L·s),答案选C。
考点:考查化学反应速率的计算

高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
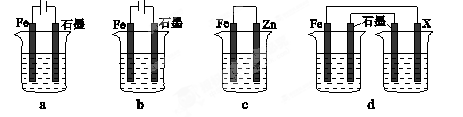
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
在一定温度下,体积固定的密闭容器中,当下列物理量:①混合气体的压强 ② 气体的总物质的量 ③混合气体的密度 ④ B的物质的量浓度不再变化时,能表明可逆反应 A(s)+2B(g)  C(g)+D(g) 已达平衡的是 ( )
C(g)+D(g) 已达平衡的是 ( )
| A.①② | B.③④ | C.①④ | D.只有④ |
在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是( )
| A.0.02 mol·L-1·s-1 | B.1.8 mol·L-1·s-1 | C.1.2 mol·L-1·s-1 | D.0.18 mol·L-1·s-1 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l)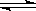 2PbCrO4(s)+ 2H+(aq)△H<0
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
| A.移走部分PbCrO4固体,Cr2O72-转化率升高 |
| B.升高温度,该反应的平衡常数(K)增大 |
| C.加入少量NaOH固体,自然沉降后,溶液颜色变浅 |
| D.加入少量K2Cr2O7固体后,溶液中c(H+)不变 |
下列有关叙述正确的是( )
A.在一定条件下,反应CO(g)+2H2(g)  CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 |
| B.常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+ c(CH3COOH)=0.01mol/L |
| C.pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① |
| D.已知某温度下:Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)= 1×10-12,,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/LK2CrO4溶液,则先产生Ag2CrO4沉淀 |
在一定温度下的恒容容器中,标志反应A(s)+2B(g)  C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
| A.混合气体的压强不随时间变化而变化 |
| B.混合气体的密度不随时间变化而变化 |
| C.气体总物质的量不随时间变化而变化 |
| D.单位时间内生成n mol C,同时消耗2n mol B |
工业上可利用甲烷除去NO气体,反应为CH4(g)+4NO(g)  CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.单位时间内消耗CH4和N2的物质的量比为1∶2时,反应达到平衡 |
| C.平衡时,其他条件不变,增加CH4的浓度,氮氧化物的转化率减小 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
一定温度下,向体积为2L的密闭容器中充入1mol PCl5(g),发生反应:
PCl5(g)  PCl3(g) +Cl2(g) △H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是
PCl3(g) +Cl2(g) △H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是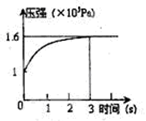
| A.3s内的平均速率为:v(PCl3)="0.1" mol·L-1.s-1 |
| B.达到平衡时放出0.6Q kJ热量 |
| C.其他条件不变,升高温度,平衡常数减小 |
| D.其他条件不变,再向容器中充入1mol PCl5(g),则达新平衡时,c(PCl5)>0.4mol·L-1 |