题目内容
已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
| A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化 |
D
解析试题分析:A.2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·mol-1 (Q>0)证明相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,错误;B.由于该反应是放热反应,所以将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量小于Q kJ,错误;C.增大压强平衡正向移动;升高温度平衡逆向移动,移动方向不同,错误;D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化,正确。
2SO3(g) ΔH=-Q kJ·mol-1 (Q>0)证明相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,错误;B.由于该反应是放热反应,所以将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量小于Q kJ,错误;C.增大压强平衡正向移动;升高温度平衡逆向移动,移动方向不同,错误;D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化,正确。
考点:考查可逆反应的特点、物质转化和能量变化的关系的知识。

练习册系列答案
相关题目
影响化学反应速率与平衡的因素有多方面,如浓度压强温度催化剂等。下列有关说法不正确的是
| A.其它条件不变时,改变压强能改变气体反应的速率,但不一定改变平衡 |
| B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D.加入催化剂能降低反应所需的活化能,使反应速率加快,平衡常数增大 |
下列叙述错误的是
| A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C.用碳酸钙粉末替代碳酸钙块状固体与盐酸反应,可以加快反应速率 |
| D.用AgNO3溶液可以鉴别KC1和KI |
在一定温度下,体积固定的密闭容器中,当下列物理量:①混合气体的压强 ② 气体的总物质的量 ③混合气体的密度 ④ B的物质的量浓度不再变化时,能表明可逆反应 A(s)+2B(g) 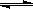 C(g)+D(g) 已达平衡的是 ( )
C(g)+D(g) 已达平衡的是 ( )
| A.①② | B.③④ | C.①④ | D.只有④ |
在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是( )
| A.0.02 mol·L-1·s-1 | B.1.8 mol·L-1·s-1 | C.1.2 mol·L-1·s-1 | D.0.18 mol·L-1·s-1 |
下列有关叙述正确的是( )
A.在一定条件下,反应CO(g)+2H2(g)  CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 |
| B.常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+ c(CH3COOH)=0.01mol/L |
| C.pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① |
| D.已知某温度下:Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)= 1×10-12,,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/LK2CrO4溶液,则先产生Ag2CrO4沉淀 |
一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
| A.加入少量稀NaOH溶液 | B.加入少量CH3COONa固体 |
| C.加入少量NH4HSO4固体 | D.加入少量Na2CO3浓溶液 |

 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。 CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )