题目内容
14.常温下在水中加入下列物质,不会破坏水的电离平衡的是( )| A. | 通入HCl气体 | B. | 加入碳酸钠固体 | C. | 加入蔗糖 | D. | 加入金属钠 |
分析 水的电离方程式为H2O?H++OH-,加入的物质或离子能影响水电离平衡的移动,则破坏水的电离.
解答 解:A.通入HCl气体,HCl在水中电离出氢离子,导致氢离子浓度增大,平衡向逆反应方向移动,则破坏水的电离,故A错误;
B.加入碳酸钠固体,在水中电离出的碳酸根结合水电离出的氢离子,破坏水的电离平衡,平衡向正反应方向移动,则破坏水的电离,故B错误;
C.加入蔗糖,蔗糖在水中不能电离,对水的电离平衡无影响,则不破坏水的电离,故C正确;
D.加入金属钠,Na与水电离的氢离子反应生成氢气,溶液中氢离子浓度减小,水的电离平衡正移,氢氧根离子浓度增大,则破坏水的电离,故D错误;
故选C.
点评 本题考查了水的电离,酸或碱能抑制水的电离,含有弱根离子的盐能促进水的电离,根据溶液中氢离子和氢氧根离子浓度是否变化来确定是否破坏水的电离,题目难度不大.

练习册系列答案
相关题目
5.下列分散系中,分散质微粒半径最小的是( )
| A. | 雾 | B. | KCl溶液 | C. | 蛋白质 | D. | 新制Cu(OH)2悬浊液 |
9.下列物质间的一步转化反应既属于分解反应又属于氧化还原反应的是( )
| A. | CaCO3→CO2 | B. | HClO→O2 | C. | HCl(浓)→MnCl2 | D. | NaBr→NaCl |
3.元素性质呈周期性变化的原因是( )
| A. | 相对原子质量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 元素的化合价呈周期性变化 | D. | 核电荷数逐渐增大 |
4.下列说法中,正确的是( )
| A. | 周期表中的各个主族都有非金属元素 | |
| B. | 周期表中的各个主族都有金属元素 | |
| C. | 周期表中的非金属元素都位于主族(除稀有气体) | |
| D. | 周期表中的非金属元素都位于短周期内 |
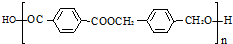 的路线:
的路线: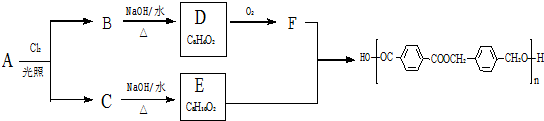
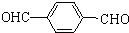 ,由B生成D的反应过程中生成的不稳定中间体的结构简式是
,由B生成D的反应过程中生成的不稳定中间体的结构简式是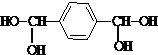 ,该中间体生成D的反应类型为消去反应.
,该中间体生成D的反应类型为消去反应.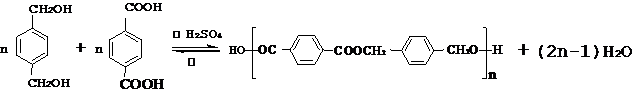 ,反应类型为缩聚反应.与E具有相同官能团的含苯环的同分异构体有(写结构简式)
,反应类型为缩聚反应.与E具有相同官能团的含苯环的同分异构体有(写结构简式)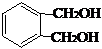 、
、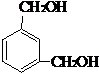 、
、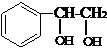 .
.
