题目内容
7.2003年3月27日据广东报道,巨大的SO2、NO等的排放量使广东成为酸雨重灾区,2002年全省酸雨频率为45.4%,占全省面积63%的17个市已被国务院划为酸雨控制区,酸雨曾使大片水稻突然枯死,并且每年因酸雨污染造成的经济损失就达40亿元左右.写出酸雨形成的化学方程式:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4、2NO+O2═2NO2、3NO2+H2O═2HNO3+NO,请提出两条防止酸雨的措施使用脱硫煤、使用清洁能源.分析 酸雨分硫酸型酸雨、硝酸型酸雨.硫酸型酸雨:排放到空气中的二氧化硫与和水反应生成亚硫酸,亚硫酸和氧气反应生成硫酸;硝酸型酸雨的形成过程是:一氧化氮被空气中氧气氧化为二氧化氮,溶于水生成硝酸;二氧化硫、氮氧化物是形成酸雨的重要物质,二氧化硫主要来源于煤的燃烧,氮氧化物主要来自于汽车尾气,据此分析防止酸雨的措施.
解答 解:酸雨分硫酸型酸雨、硝酸型酸雨.硫酸型酸雨:二氧化硫和水反应生成亚硫酸,亚硫酸能和氧气反应生成硫酸,反应的化学方程式分别为:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4,硝酸型酸雨的形成过程是NO被O2氧化为二氧化氮,二氧化氮溶于水生成硝酸:2NO+O2=2NO2; 3NO2+H2O=2HNO3+NO,防止或减少酸雨的产生,使用脱硫煤,使用清洁能源,例如氢能、太阳能、水能等,可以防止产生二氧化硫、二氧化氮的排放,从而防止或减少酸雨的产生,
故答案为:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4;2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;使用脱硫煤;使用清洁能源.
点评 本题考查了酸雨的成因以及防止措施,二氧化硫、氮氧化物是形成酸雨的重要物质,因此控制二氧化硫、氮氧化物产生的源头,就可以防止酸雨的形成,题目难度不大.

练习册系列答案
相关题目
17.下列关于1.5mol 氢气的叙述中,错误的是( )
| A. | 质量是4g | B. | 标准状况下的体积约为33.6L | ||
| C. | 电子数是3mol | D. | 分子数是9.03×1023 个 |
18.一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列叙述正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列叙述正确的是( )
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
15.卤化氢(HX)中稳定性最弱的是( )
| A. | HF | B. | HCl | C. | HBr | D. | HI |
12.某一反应物的浓度是1.2mol/L,经过20s后,它的浓度变成了0.4mol/L,在这20s内它的化学反应速率为( )
| A. | 0.04 | B. | 0.04mol/(L.s) | C. | 0.08mol(L.s) | D. | 0.04mol/L |
19.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是Ar(填元素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠溶液反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
(4)⑥和⑦分别与氢形成的氢化物中,较稳定的是HCl(填化学式).
(5)元素④与⑥形成的化合物属于离子(填“共价”或“离子”)化合物;用电子式表示其形成过程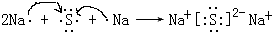 .
.
(6)表示①与③形成的化合物的电子式 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠溶液反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
(4)⑥和⑦分别与氢形成的氢化物中,较稳定的是HCl(填化学式).
(5)元素④与⑥形成的化合物属于离子(填“共价”或“离子”)化合物;用电子式表示其形成过程
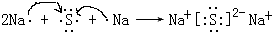 .
.(6)表示①与③形成的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
16.下列溶液一定显酸性的是( )
| A. | 含H+的溶液 | B. | H+浓度为1×10-6 mol/L的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
1.实验室里用下列仪器和药品来制取纯净的无水氯化铜:
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 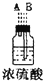 | 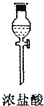 | 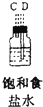 | 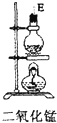 | 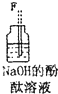 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.