题目内容
2.理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+═2Ag+Cu2+”设制一个化学电池,并回答下列问题:(1)该电池的负极材料是Cu,正极材料是C,电解质溶液是AgNO3溶液.
(2)在外电路中,电子方向是从负极到正极.(填正或负)
(3)负极上出现的现象是铜溶解附近溶液变蓝色
正极上出现的现象是碳棒上出现银白色物质
(4)负极的电极反应式:Cu-2e-=Cu2+,正极的电极反应式:2Ag++2e-=2Ag.
分析 在Cu+2Ag+=2Ag+Cu2+反应中,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,Ag+得电子被还原生成单质Ag,正极上有银白色物质生成,电极反应为Ag++e-=Ag,应为原电池正极反应,正极材料为活泼性比Cu的金属或非金属材料,电解质溶液为含Ag+离子的溶液,如AgNO3,
原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极移动,阴离子向负极移动,以形成闭合回路.
解答 解:(1)在Cu+2Ag+=2Ag+Cu2+反应中,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,正极为C,电解质溶液为含Ag+离子的溶液,如AgNO3,故答案为:Cu;C;AgNO3溶液;
(2)在外电路中,电子方向是从负极到正极,故答案为:负;正;
(3)负极上Cu-2e-=Cu2+,所以现象为铜溶解附近溶液变蓝色,正极Ag+得电子被还原生成单质Ag,正极上有银白色物质生成,
故答案为:铜溶解附近溶液变蓝色;碳棒上出现银白色物质;
(4)负极上Cu-2e-=Cu2+,正极反应为Ag++e-=Ag,故答案为:Cu-2e-=Cu2+;2Ag++2e-=2Ag.
点评 本题考查原电池的设计,题目难度不大,注意两极材料的判断以及电极反应式的书写方法.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
12.某溶液中含有Cl-、K+、H+、SO42-,组成该溶液的化合物最多有( )
| A. | 2种 | B. | 3 种 | C. | 5种 | D. | 6种 |
13.有下列四组物质,每组内物质互为同分异构体的是( )
| A. | 12C和14C | B. | 金刚石与石墨 | ||
| C. | CH3CHO与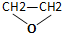 | D. | CH3CHCH2CH3与CH3CH2CH2CHCH3 |
14.对于密闭容器中进行的反应:P(g)+Q(g)?R(g)+S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是( )
| A. | P、Q、R、S的物质的量浓度之比为:1:1:1:1 | |
| B. | P、Q、R、S在密闭容器中共存 | |
| C. | P、Q、R、S的物质的量浓度不再变化 | |
| D. | v(Q)=v(R) |
12.化学知识在生产和生活中有着重要的应用.下列说法中正确的是( )
| A. | 明矾常作为消毒剂 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等 |