题目内容
15.卤化氢(HX)中稳定性最弱的是( )| A. | HF | B. | HCl | C. | HBr | D. | HI |
分析 元素的非金属性越强,对应的氢化物越稳定,结合同主族元素的性质的递变规律解答该题.
解答 解:同主族元素从上到下元素的非金属性逐渐减弱,F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,
则稳定性HF>HCl>HBr>HI,
所以稳定性最弱的为HI,
故选D.
点评 本题考查同主族元素的性质的递变规律,为高频考点,侧重于基本概念、基本规律的考查,注意把握元素周期率知识以及元素周期表的结构及其应用,把握性质比较的角度,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
5.能用离子方程式H++OH-═H2O表示的化学方程式是( )
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | B. | KOH+HCl═KCl+H2O | ||
| C. | Cu(OH)2+H2SO4═CuSO4+2H2O | D. | 2NaOH+H2S═Na2S+2H2O |
6.下列溶液中的Cl- 数目与25mL 0.1mol•L-1的AlCl3溶液中Cl-数目相等的是( )
| A. | 25mL 0.1mol•L-1的BaCl2溶液 | B. | 50mL 0.3mol•L-1的NaCl溶液 | ||
| C. | 50 mL0.3mol•L-1的FeCl3溶液 | D. | 75 mL 0.1mol•L-1的KCl溶液 |
3.某学习小组利用下列装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3.
(1)如图1所示,选取必要的实验装置,正确的连接顺序为CAB(填序号)
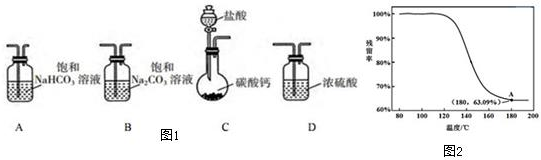
(2)为确定制得的固体样品是纯净的NaHCO3 小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2 观察现象.
丙方案:测定pH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判定乙方案的可行性,某同学用分析纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
(Ⅰ)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[已知:0.1 mol•L-1NaHC03溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案如下:
取m克的固体样品溶解于水配成Vml的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结论是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}×100%$)
(1)如图1所示,选取必要的实验装置,正确的连接顺序为CAB(填序号)

(2)为确定制得的固体样品是纯净的NaHCO3 小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2 观察现象.
丙方案:测定pH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判定乙方案的可行性,某同学用分析纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑池 | 无现籴 |
| 0.02mol•L-1 | 少许浑油 | 尤现象 | 尤现象 |
[已知:0.1 mol•L-1NaHC03溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案如下:
取m克的固体样品溶解于水配成Vml的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结论是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}×100%$)
20.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电池反应为2H2+4OH--4e-═4H2O和O2+H2O+4e-═4OH-,则下列叙述正确的是( )
| A. | 通氢气的一极是正极,通氧气的一极是负极 | |
| B. | 通氢气的一极发生的是氧化反应 | |
| C. | 工作一段时间后电解质溶液的pH值增大 | |
| D. | 工作时负极区附近的pH值增大 |
4.下列哪组溶液混合后最先出现浑浊的是( )
| 编号 | H2SO4 | Na2S2O3 | H2O(ml) |
| A | 5ml 0.1mol/L | 5ml 0.1mol/L | 0 |
| B | 5ml 0.2mol/L | 5ml 0.1mol/L | 10 |
| C | 5ml 0.3mol/L | 5ml 0.1mol/L | 20 |
| D | 5ml 0.4mol/L | 5ml 0.1mol/L | 30 |
| A. | A | B. | B | C. | C | D. | D |
5.下列各组物质中,按熔点由高到低的顺序排列正确的是( )
| A. | H2O、H2S、H2Se | B. | Hg、Na、NaCl | ||
| C. | 晶体硅、金刚石、碳化硅 | D. | S、Br2、O3 |