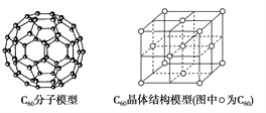
题目内容
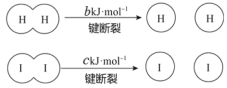
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
【答案】B
【解析】
A. 放热反应中反应物的总能量高于生成物的总能量。该反应放热,所以反应物的总能量高于生成物的总能量,A选项正确;
B. 该反应放热,说明反应物断键吸收的能量低于形成生成物成键放出的能量,而同一化学键断开吸收的能量和形成放出的能量相等,所以,断开1 mol H—H键和1 mol I—I键所需能量总和小于断开2 mol H—I键所需能量,B选项错误;
C. 反应放出的热约为成键放出的能量减去断键吸收的能量:akJ=断开2 mol H—I键所需能量-bkJ-ckJ,所以,断开 2 mol H—I 键所需能量约为(c+b+a)kJ,C选项正确;
D. 该反应是可逆反应,向密闭容器中加入2 mol H2和2 mol I2,反应的H2小于2mol,所以,充分反应放出的热量小于2a kJ,D选项正确;
答案选B。

 新思维假期作业暑假吉林大学出版社系列答案
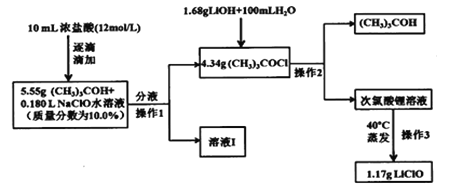
新思维假期作业暑假吉林大学出版社系列答案【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+ O2(g)![]() 2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. T1、T2的关系:T1 > T2
B. x= 1.6,y=0.2 ,t<6
C. K1、K2的关系:K2>K1
D. 实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D