题目内容
【题目】次氯酸锂稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸锂方法较多,常用的一种合成路线如图:
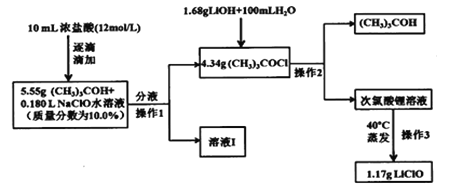
已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
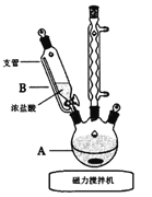
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是________;②浓盐酸逐滴滴加而不是一次性加入的原因是__________。
(2)请写出在装置A中发生反应的化学方程式______________。
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因___________。
(4)该实验中次氯酸锂的产率为_________。
【答案】平衡气压,使浓盐酸顺利下滴 防止反应太剧烈而发生副反应,引起产率降低 (CH3)3COH+NaClO+HCl=(CH3)3COCl+NaCl+H2O 蒸发时,溶液温度太高,会引起次氯酸根的水解,且生成的次氯酸不稳定,导致产品产率和纯度降低 50.0%
【解析】
(1)B装置中支管使滴液漏斗中液面上方气压与三颈烧瓶中液面上方的气压相等;从反应速率和物质转化率方面分析;
(2)装置A中(CH3)3COH、NaClO、HCl反应有(CH3)3COCl生成,整个过程为NaClO与HCl反应生成NaCl与HClO,HClO与(CH3)3COH发生酯化反应生成(CH3)3COCl与H2O;
(3)从次氯酸盐的水解、HClO的分解分析判断;
(4)先4.34g(CH3)3COCl、1.68gLiOH的物质的量,结合二者按物质的量1:1反应,判断哪种物质过量,然后以不足量的物质为标准计算,(CH3)3COH的理论产量为0.04mol,再结合产率=![]() ×100%计算。
×100%计算。
(1)①B装置中支管使滴液漏斗中液面上方气压与三颈烧瓶中液面上方的气压相等,可以平衡气压,使浓盐酸顺利下滴;
②浓盐酸逐滴滴加而不是一次性加入,原因是防止反应太剧烈而发生副反应,引起产率降低;
(2)装置A中(CH3)3COH、NaClO、HCl反应有(CH3)3COCl生成,整个过程为NaClO与HCl反应生成NaCl与HClO,HClO与(CH3)3COH发生酯化反应生成(CH3)3COCl与H2O,反应方程式为:(CH3)3COH+NaClO+HCl=(CH3)3COCl+NaCl+H2O;
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,原因是蒸发时,若溶液温度太高,会引起次氯酸根的水解反应程度增大,且生成的次氯酸不稳定,导致产品产率和纯度降低,故选择在40°C下缓慢蒸发溶液;
(4)4.34g(CH3)3COCl的物质的量为4.34g÷108.5g/mol=0.04mol,1.68gLiOH的物质的量为1.68g÷24g/mol=0.07mol,二者按物质的量1:1反应,故(CH3)3COCl不足量,则(CH3)3COH的理论产量为0.04mol,产率=![]() ×100%=
×100%=![]() ×100%=50.0%。
×100%=50.0%。

【题目】Ⅰ.把在空气中久置的铝片 5.4g 投入盛有 500mL0.5molL-1 盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:

(1)曲线由 0→a 段不产生氢气的原因______, 用离子方程式表示为______;
(2)曲线由 b→c 段产生氢气的速率增加较快的主要原因______。
(3)向溶液中加入下列物质,能加快上述化学反应速率的是______。
A 蒸馏水 B 改用铝粉 C 饱和氯化钠溶液 D 浓盐酸 E 少量硫酸铜溶液.
Ⅱ.在 2 L 密闭容器中,800 ℃时反应 2NO+O2![]() 2NO2 体系中,n(NO)随时间的变化如下表:
2NO2 体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(4)如图表示各物质浓度的变化曲线,B 点处,v(正)_______v(逆),(用“大于”“小于”或“等于”填空)。

(5)能说明该反应已经达到平衡状态的是______。
a 容器内压强保持不变 b v(NO)=2v(O2)
c 容器内的密度保持不变 d 2v逆(NO2)=v正(O2)