题目内容
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A.气态氢化物的沸点:H2T>H2Y>H2R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.Z的含氧酸的酸性比Y的强
【答案】AD
【解析】
Z单质与H2混合遇强光会发生爆炸,Z是Cl元素,根据元素R、T、X、Y、Z在元素周期表中的相对位置,R、T、X、Y分别是O、Se、P、S。
A. 水分子间能形成氢键,气态氢化物的沸点:H2O>H2Se>H2S,故A错误;
B. R是O、Y是S,电子数相差8,故B正确;
C. 同周期元素从左到右非金属性增强,非金属性Cl>S>P,故C正确;
D. 酸性:HClO<H2SO4、HClO4>H2SO4,Cl的含氧酸的酸性不一定比S的强,故D错误;
选AD。

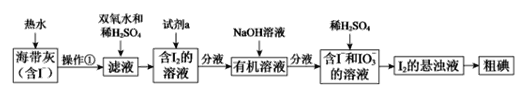
【题目】PbCO3广泛用于陶瓷、油漆和颜料配制等。一种由方铅矿(主要成分为PbS,含少量FeS)和软锰矿(主要成分为MnO2)为原料制备PbCO3的流程如图:
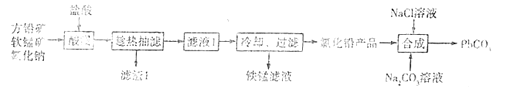
已知:①“酸浸”时PbS反应的方程式为PbS+MnO2+4Cl-+4H+=== PbCl42-+Mn2++S+2H2O。PbCl2易溶于热水,难溶于冷水。在盐酸中因与Cl-形成配合离子PbCl42-而增大PbCl2的溶解度.
②常温下,几种金属离子沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 7.5 | 8.8 |
完全沉淀的pH | 2.3 | 9.7 | 10.4 |
(1)“酸浸”之前需要将方铅矿、软锰矿和氧化钠粉碎并混合均匀,其目的是____。
(2)“趁热抽滤”的目的是___。
(3)铁锰滤液中阳离子主要是Mn2+,还含少量Fe3+、Fe2+。从铁锰滤液中得到较纯锰盐溶液有两种方案:
方案甲:向滤液中加入酸化的双氧水,再加入足量MnCO3粉末,过滤得到锰盐溶液。
方案乙:向滤液中加入稀硫酸酸化,然后加入二氧化锰粉末,充分反应;最后,加氨水调节溶液pH,过滤。
①方案甲中加入MnCO3的目的是_____。
②用离子方程式表示方案乙中“加入二氧化锰”的作用:____。
已知常温下,Ksp[Fe(OH)3]≈1.0×10-38,为了使溶液中c(Fe3+)=1.0×10-5mol·L-1,此时溶液的pH= ____。
③从操作、产品纯度角度考虑,方案____(填“甲”或”乙”)优于另一种方案。
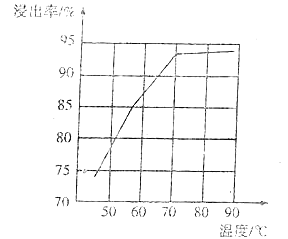
(4)研究工业生产中温度对浸出率的影响如图所示,则生产中浸出过程的最佳温度是___。
(5)向氯化铅(难溶于水)产品中加入氯化钠溶液和碳酸钠溶液,得到碳酸铅产品后,要经过“过滤、洗涤、干燥”等操作,检验碳酸铅是否洗涤干净的操作是____。