题目内容
12.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ•mol-1
2H2S(g)═2H2(g)+S2(g)△H=+169.8kJ•mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ•mol-1.
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是为H2S热分解反应提供热量
,.燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:2H2S+SO2═2H2O+3S↓.
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示.图中A、B表示的物质依次是氢气、氧气.
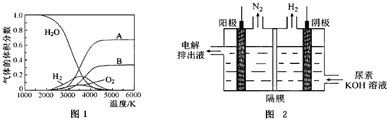
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
(5)Mg2Cu是一种储氢合金.350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077).Mg2Cu与H2反应的化学方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2.
分析 (1)依据盖斯定律,利用热化学方程式计算得到所需热化学方程式,书写化学方程式,标注物质聚集状态和对应反应量的反应热;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;SO2与H2S发生硫元素的归中反应;
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,据此判断;
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2.
解答 解:(1)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ•mol-1
依据盖斯定律①×2-②得到:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8 kJ•mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8 kJ•mol-1;
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,燃烧生成的SO2与H2S反应生成H2O+S,反应的化学方程式为:2H2S+SO2═2H2O+3S↓,故答案为:为H2S热分解反应提供热量;2H2S+SO2═2H2O+3S↓;
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢气、B为氧气.
故答案为:氢气、氧气.
(4)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2,
故答案为:2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2.
点评 本题考查热化学方程式的书写、电解原理、常用化学用语书写等,主要是氧化还原反应电子转移计算,电解池原理的分析判断,掌握基础是关键,题目难度中等.

| A. | Fe3O4俗称铁红,常做红色油漆和涂料 | |
| B. | 燃料电池的燃料都在负极发生氧化反应 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
| A. |  净化精制淀粉胶体 | B. |  测定化学反应速率 | ||
| C. |  验证Na与水反应是否放热 | D. | 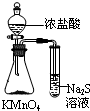 比较KMnO4、Cl2、S的氧化剂 |
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
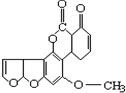
| A. | 1mol该化合物最多消耗H2和NaOH分别为6 mol和2 mol | |
| B. | 该化合物中含有三种官能团 | |
| C. | 该化合物中含有2个苯环结构 | |
| D. | 该化合物可以和1mol Br2发生加成反应 |
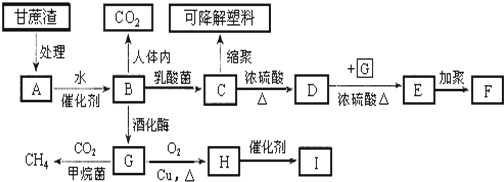
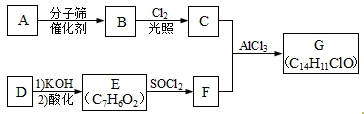
 ;六元环状化合物I
;六元环状化合物I .
.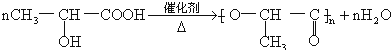 .
.
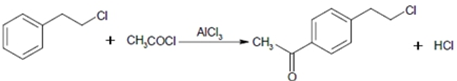
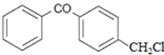 .
.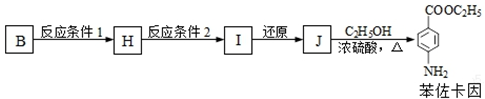
 .
.