题目内容
20.下列有关电解质溶液中粒子浓度关系正确的是( )| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO)+2c(H2CO3)+2c(CO) |
分析 A.氯化银的溶解度大于碘化银,则氯离子浓度大于碘离子;
B.根据硫酸氢钠溶液中的电荷守恒和物料守恒分析;
C.氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,由此分析解答;
D.根据物料守恒,分析解答.
解答 解:A.含有AgCl和AgI固体的悬浊液,碘化银的溶解度小于氯化银,则氯离子浓度大于碘离子,溶液中离子浓度大小为:c(Ag+)>c(Cl-)>c(I-),故A错误;
B.根据电荷守恒,pH=1的NaHSO4溶液存在:c(Na+)+c(H+)=2c(SO42-)+c(OH-),因为c(Na+)=c(SO42-),所以c(H+)=c(SO42-)+c(OH-),故B正确;
C.H+抑制NH4+水解、CH3COO-促进NH4+水解,所以铵根离子浓度大小顺序是③>①>②,故C错误;
D.根据物料守恒,2c(HClO)+2c(ClO-)═c(HCO)+c(H2CO3)+c(CO),故D错误;
故选B.
点评 本题考查了离子浓度大小比较、难溶物溶解平衡应用、弱电解质的电离等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒的含义,明确难溶物溶解平衡及其应用方法.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
8.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 非金属性越强,其气态氢化物越稳定 | 稳定性:NH3>PH3 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片中分别加入足量的浓、稀硝酸,浓硝酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 浓硫酸不能干燥具有还原性的气体 | 浓硫酸不可以干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
5.在2L恒容密闭容器中充入3mol CO气体、3mol H2,发生反应:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g).CO的平衡转化率(α)与温度、压强的关系如图所示:( )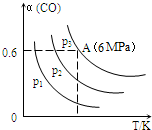

| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |



 .
.
 下列说法正确的是( )
下列说法正确的是( )