题目内容
17.下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是( )| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
分析 (NH4)2Fe(SO4)2在溶液中电离出Fe2+、NH4+、SO42-,
A.镁离子、亚铁离子都与一水合氨反应生成沉淀;
B.氢氧化钡足量,硫酸根离子、亚铁离子和铵根离子都参与反应,漏掉了铵根离子与氢氧根离子的反应;
C.亚铁离子被空气中氧气氧化成铁离子,反应产物中氢氧化铁沉淀和硫酸铁、硫酸铵,据此判断离子方程式;
D.铁离子和锰离子都是有色离子,所以反应后溶液不可能为无色.
解答 解:(NH4)2Fe(SO4)2在溶液中电离出Fe2+、NH4+、SO42-,
A.Mg2+、Fe2+与NH3•HO2之间反应生成沉淀,在溶液中不能大量共存,故A错误;
B.(NH4)2Fe(SO4)2与足量Ba(OH)2溶液反应生成一水合氨、氢氧化亚铁和硫酸钡沉淀,正确的离子方裎式为:2NH4++Fe2++2SO42-+2Ba2++4OH-=Fe(OH)2↓+2BaSO4↓+2NH3•H2O,
C.(NH4)2Fe(SO4)2溶液久置空气中被氧气氧化成铁离子,部分铁离子转化成氢氧化铁沉淀,反应的离子方程式为:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+,故C正确;
D.向该溶液中滴加适量的酸性KMnO4溶液,亚铁离子被氧化成铁离子,高锰酸根离子被还原成锰离子,铁离子和锰离子都是有色离子,所以反应后的溶液不可能变为无色,故D错误;
故选C.
点评 本题考查了离子方程式书写、离子共存的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子共存的条件,D为易错点,注意反应后的溶液不可能为无色,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.对下表中实验操作或现象的解释不合理的是( )
| 实验操作及现象 | 现象的解释 | |
| A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
| B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
| C | 往水中加入Na2O2固体,滴入酚酞呈红色,振荡,红色褪去 | 产生了碱性物质,且Na2O2具有漂白性 |
| D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
| A. | A | B. | B | C. | C | D. | D |
8.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 非金属性越强,其气态氢化物越稳定 | 稳定性:NH3>PH3 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片中分别加入足量的浓、稀硝酸,浓硝酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 浓硫酸不能干燥具有还原性的气体 | 浓硫酸不可以干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
5.在2L恒容密闭容器中充入3mol CO气体、3mol H2,发生反应:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g).CO的平衡转化率(α)与温度、压强的关系如图所示:( )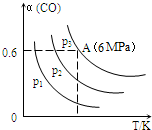

| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=$\frac{1}{64}$(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |
3.常温下,下列表述正确的是( )
| A. | pH=2的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 | |
| B. | 向NaHC03溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO-)增 大 | |
| C. | Na2C03溶液中:即c(Na+)>C(CO32-)>C(OH-)=C(HCO3-)>C(H+) | |
| D. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-) |
 .
.
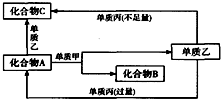 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).