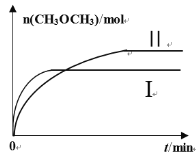
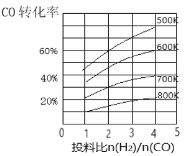
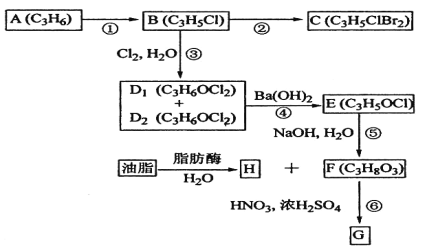
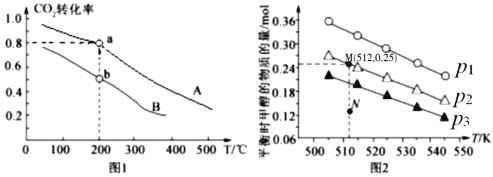
题目内容
【题目】纳米微晶![]() (碱式碳酸锌)属于高端精细化工产品,晶粒粒度在
(碱式碳酸锌)属于高端精细化工产品,晶粒粒度在![]() ,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为
,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为![]() ,含少量
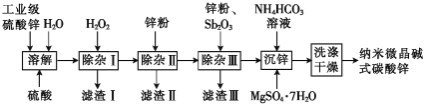
,含少量![]() )制备纳米微晶碱式碳酸锌样品的流程如图所示:
)制备纳米微晶碱式碳酸锌样品的流程如图所示:
已知:a.![]() 的
的![]() 分别是37.4、15.4、16.2。
分别是37.4、15.4、16.2。
b.残留在溶液中的离子浓度小于![]() 时可认为沉淀完全。
时可认为沉淀完全。
c.滤渣Ⅲ所含主要金属元素是![]() 。
。
(1)“除杂Ⅰ”的目的是除去溶液中的铁元素,则![]() 的作用是________________;若溶液中
的作用是________________;若溶液中![]() ,此过程中还应调节溶液的
,此过程中还应调节溶液的![]() 在____范围(不考虑离子间的相互影响)。
在____范围(不考虑离子间的相互影响)。
(2)“除杂Ⅱ”与“除杂Ⅲ”均为还原除杂。
①滤渣Ⅱ的主要金属元素是_________________________
②“除杂Ⅲ”中加入的![]() 在溶液中主要以
在溶液中主要以![]() 形式存在。请写出锌与
形式存在。请写出锌与![]() 反应生成“金属间化合物”
反应生成“金属间化合物”![]() (
(![]() 中各元素化合价视为0价)的离子方程式:___________________________
中各元素化合价视为0价)的离子方程式:___________________________
(3)“沉锌”后得到的固体先用去离子水洗涤,再用乙醇洗涤。用乙醇洗涤的目的是_______________________
(4)加入![]() 的主要目的是降低样品晶粒粒度,但主元素
的主要目的是降低样品晶粒粒度,但主元素![]() 的质量分数必须在56%以上。若镁、锌的质量比值过高,
的质量分数必须在56%以上。若镁、锌的质量比值过高,![]() 还可能会生成_________(填化学式),从而对样品造成影响。
还可能会生成_________(填化学式),从而对样品造成影响。
(5)样品中锌的含量可用![]() (可表示为
(可表示为![]() )滴定测定,反应的离子方程式为
)滴定测定,反应的离子方程式为![]() 。取
。取![]() 纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用
纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用![]() 标准溶液滴定,消耗
标准溶液滴定,消耗![]() 溶液
溶液![]() ,则样品中锌的质量分数是_______(用代数式表示)。
,则样品中锌的质量分数是_______(用代数式表示)。
【答案】将![]() 氧化成
氧化成![]() ,以便形成氢氧化铁沉淀而除去 3.2≤pH<5.9 Cu、Cd
,以便形成氢氧化铁沉淀而除去 3.2≤pH<5.9 Cu、Cd ![]() 去除固体表面的水,便于干燥
去除固体表面的水,便于干燥 ![]() [或
[或![]() ]
] ![]()
【解析】
根据工艺流程分析可知,工业级硫酸锌加水、硫酸溶解酸化后加入H2O2,将Fe2+氧化为Fe3+,控制pH将其沉淀为Fe(OH)3,过滤除去,除杂Ⅱ向滤液中加入锌粉,除去Cu2+和Cd2+,除杂Ⅲ再加入锌粉和少量Sb2O3,形成锑锌原电池,除去Co2+、Ni2+,过滤,再向滤液中加入NH4HCO3溶液和MgSO4·7H2O沉锌,洗涤干燥沉淀可得到产品,据此分析解答。
(1) “除杂Ⅰ”的目的是除去溶液中的铁元素,加入适量的H2O2溶液,可将Fe2+氧化为Fe3+,以便形成氢氧化铁沉淀而除去,已知![]() 的
的![]() 分别是37.4、15.4、16.2,则Ksp[Fe(OH)3]=10-37.4,Ksp[Zn(OH)2]=10-16.2,若溶液中c(Zn2+)=1.0mol/L,Zn(OH)2开始沉淀时,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-),则
分别是37.4、15.4、16.2,则Ksp[Fe(OH)3]=10-37.4,Ksp[Zn(OH)2]=10-16.2,若溶液中c(Zn2+)=1.0mol/L,Zn(OH)2开始沉淀时,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-),则![]() ,c(H+)=10-5.9mol/L,此时溶液的pH=5.9,要使Zn2+不沉淀,则pH<5.9,残留在溶液中的离子浓度小于
,c(H+)=10-5.9mol/L,此时溶液的pH=5.9,要使Zn2+不沉淀,则pH<5.9,残留在溶液中的离子浓度小于![]() 时可认为沉淀完全,则Fe3+完全沉淀时,c(Fe3+)=1.0×10-5mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),则
时可认为沉淀完全,则Fe3+完全沉淀时,c(Fe3+)=1.0×10-5mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),则![]() ,c(H+)=10-3.2mol/L,此时溶液的pH=3.2,要使Fe3+完全沉淀,则pH≥3.2,故答案为:将
,c(H+)=10-3.2mol/L,此时溶液的pH=3.2,要使Fe3+完全沉淀,则pH≥3.2,故答案为:将![]() 氧化成
氧化成![]() ,以便形成氢氧化铁沉淀而除去;3.2≤pH<5.9;
,以便形成氢氧化铁沉淀而除去;3.2≤pH<5.9;
(2)①除杂Ⅱ向滤液中加入锌粉还原除去Cu2+和Cd2+,滤渣Ⅱ的主要成分是Cu、Cd,故答案为:Cu、Cd;
②Zn与Co2+、HSbO2生成“金属间化合物”CoSb(CoSb中各元素的化合价视为0价),Co元素的化合价由+2价降低至0价,Sb元素的化合价由+3价降低至0价,则生成CoSb化合价降低5价,而Zn元素的化合价由0价升高至+2价,根据得失电子守恒配平该反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)碱式碳酸锌不溶于乙醇,且乙醇与水互溶,用乙醇洗涤可去除固体表面的水,便于干燥,故答案为:去除固体表面的水,便于干燥;
(4)若镁、锌的质量比值过高,Mg2+浓度较大,可能会生成![]() [或
[或![]() ],故答案为:
],故答案为:![]() [或
[或![]() ];
];
(5)根据![]() 可知,Zn2+~EDTA(H2Y2-),则n(Zn2+)=n(EDTA),则样品中锌的质量分数是
可知,Zn2+~EDTA(H2Y2-),则n(Zn2+)=n(EDTA),则样品中锌的质量分数是![]() ,故答案为:
,故答案为:![]() 。
。