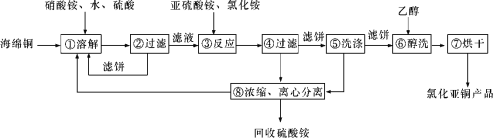
题目内容
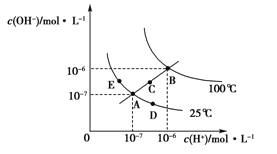
【题目】常温下,用0.1mol·L-1MgSO4和0.05mol·L-1Al2(SO4)3溶液进行实验:①各取25mL,分别滴加0.5mol·L-1NaOH溶液,测得溶液pH与V(NaOH)的关系如图1;②将两种溶液等体积混合后,取出25mL,逐滴加入上述NaOH溶液,观察现象。下述正确的是 ( )
图1 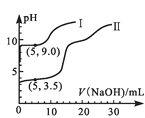 图2
图2
A.图1中的曲线II表示MgSO4与NaOH反应的关系
B.根据图1可得Ksp[Al(OH)3]的值大于1.0×10-32
C.实验②中Al(OH)3完全溶解前,溶液中c(Mg2+)/c(Al3+)逐渐变大
D.图2可以表示实验②中n(沉淀)与V(NaOH)的关系
【答案】C
【解析】
A.Mg的金属性强于Al,Mg(OH)2的碱性强于Al(OH)3,浓度相同的Mg2+水解程度小于Al3+,V(NaOH)=0时,相同浓度的镁铝离子溶液中MgSO4pH大,故图1中的曲线I表示MgSO4与NaOH反应的关系,与题意不符,A错误;
B.图1中(5,3.5)点时溶液中c(H+)=10-3.5mol/L,c(OH-)=10-10.5mol/L,若铝离子未反应,则c(Al3+)=![]() =0.08mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=0.08×(10-10.5)3=8×10-33.5<1.0×10-32,与题意不符,B错误;
=0.08mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=0.08×(10-10.5)3=8×10-33.5<1.0×10-32,与题意不符,B错误;
C.由图1可知,Al3+先沉淀,Mg2+后沉淀,并且pH=5时Al3+沉淀完全,pH=9时Mg2+开始沉淀、Al(OH)3开始溶解,实验②溶液中,随着NaOH的加入,Al3+先沉淀到完全、再溶解,所以Al(OH)3完全溶解前,溶液中c(Mg2+):c(Al3+)逐渐增大,符合题意,C正确;
D.25mL实验②溶液中n(Al3+)=n(Mg2+)=0.5×25×10-3L×0.1mol/L=1.25×10-3mol,由Al3+~Al(OH)3~3OH-可知,Al3+完全沉淀时消耗V(NaOH)=1.25×103mol×3×0.5mol/L=7.5mL,再加入5mlNaOH即加入NaOH总体积为12.5mL时,溶液中c(OH-)=5×0.5×103mol×(25+7.5+5)×103L=0.067mol/L,pH≈12.8>9,此时Al(OH)3几乎溶解完全、Mg(OH)2几乎沉淀完全,所以加入NaOH体积大于7.5ml时,Al(OH)3开始溶解而减少、Mg(OH)2沉开始淀,所以实验②中n(沉淀)与V(NaOH)的关系不是直线上升的关系,即不能表示实验②中n(沉淀)与V(NaOH)的关系,与题意不符,D错误;
答案为C。

【题目】回答下列问题:
I.乳酸(![]() )、酒精、醋酸、淀粉等都是生活中常见的物质。
)、酒精、醋酸、淀粉等都是生活中常见的物质。
(1)在生活中,常选择上述物质中_______________(填结构简式)清洗水壶里的水垢。
(2)生活中常选择_______________酒精![]() 选择“75%”“95%”或“无水”
选择“75%”“95%”或“无水”![]() 皮肤消毒。
皮肤消毒。
(3)上述物质中,属于天然高分子化合物的是_________________![]() 填名称
填名称![]() 。
。
(4)乳酸中发生如下变化:![]() ,则所用的试剂a为________(写化学式)。
,则所用的试剂a为________(写化学式)。
II.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最外层电子数是次外层的2倍 |
Y | M层上的电子数是K层的3倍 |
Z | Z的一种核素的质量数为53,中子数为34 |
W | W2+与氖原子具有相同核外电子排布 |
(5)X在元素周期表中的位置为___________;Y元素的名称为________________。
(6)元素W的离子结构示意图是_______________;Z、Y形成的化合物为____________(用化学式表示)。