题目内容
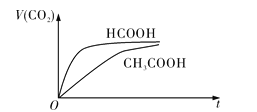
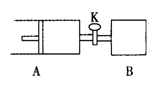
【题目】如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
A.反应速率:v(B)<v(A)
B.平衡时Y的体积分数:A>B
C.打开K后达平衡时A的体积为2.4a L
D.A容器中X的转化率为80%
【答案】D
【解析】
A.加入反应物X和Y,该反应将向正反应方向进行建立化学平衡。容器A保持恒压,在建立化学平衡的过程中,反应混合物的总物质的量会增大,其体积要增大,各组分的物质的量浓度就要减下,反应速率也要减小。B容器保持恒容,体积不变,各组分初始浓度是A容器的2倍,反应速率始终都将大于A容器,即反应速率:v(B)>v(A),A错误;
B.B平衡相当于把A平衡增大了压强,由于增大压强,平衡朝逆方向进行,所以B容器中Y的体积分数要比A容器的大,B错误;
C.若打开K,相当于等压条件下,与原来的A平衡等效,故反应后的总体积为1.4a×3=4.2a,所以则达到新的化学平衡时,A的体积为4.2aL,C错误;
D.列三段式为
X(g)+Y(g)![]() 2Z(g)+W(g)
2Z(g)+W(g)
初始: 1 1 0 0
转化 x x 2x x
平衡 1-x 1-x 2x x
根据阿伏加德罗定律的推论:同温同容时,压强之比等于物质的量之比,得:
![]() =
=![]() ,A容器的体积之比等于气体物质的量之比,可以得出x=0.8,A容器中X的转化率为80%,D正确;
,A容器的体积之比等于气体物质的量之比,可以得出x=0.8,A容器中X的转化率为80%,D正确;
答案选D。

【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D